üĒ(l©ói)į┤Ż║ŠW(w©Żng)Įj(lu©░)┘Yį┤ ū„š▀Ż║ųą┐╝ŠW(w©Żng)š¹└Ē 2019-08-26 17:24:33
ĪĪĪĪ╩└ķg╚f(w©żn)╬’Č╝╩Ūė╔į¬╦žĮM│╔Ą─����Ż¼▓╗╣▄╩Ūč§ĘųūėųąĄ─č§įŁūė▀Ć╩Ū╦«ĘųūėųąĄ─č§įŁūė����Ż¼Č╝╩Ūč§į¬╦žĄ─įŁūėĪŻį¬╦ž╩Ū═¼ę╗ŅÉįŁūė(║╦ļŖ║╔öĄ(sh©┤)ŽÓ═¼Ą─įŁūė)Ą─┐éĘQ��ĪŻ▓╗═¼į¬╦žĄ─įŁūė▓╗═¼��Ż¼ĄĮ─┐Ū░×ķų╣��Ż¼╚╦éā?c©©)┌ūį╚╗Įńųą░l(f©Ī)¼F(xi©żn)Ą─į¬╦žėą90ėÓĘN���Ż¼╚╦╣ż║Ž│╔Ą─į¬╦žėą20ėÓĘN���Ż¼Č╝╩šõøį┌╬ęéāšn▒ŠĖĮõøĄ─į¬╦žų▄Ų┌▒ĒųąĪŻį¬╦žĘ¹╠¢(h©żo)╩ŪīW(xu©”)┴Ģ(x©¬)║═蹊┐╗»īW(xu©”)Ą─╚╦Č╝æ¬(y©®ng)įōšJ(r©©n)ūR(sh©¬)Ą─Ę¹╠¢(h©żo)����Ż¼į¬╦žĘ¹╠¢(h©żo)│²┴╦▒Ē╩Šę╗ĘNį¬╦ž═ŌŻ¼ę▓┐╔▒Ē╩Š▀@ĘNį¬╦žĄ─ę╗éĆ(g©©)įŁūė�Ż¼╚ńCl│²▒Ē╩Š┬╚į¬╦ž����Ż¼▀Ć▒Ē╩Šę╗éĆ(g©©)┬╚įŁūė���ĪŻ
ĪĪĪĪį┌į¬╦žĘ¹╠¢(h©żo)ėę╔ŽĮŪś╦(bi©Īo)│÷ļxūė╦∙Ħš²��Īóžō(f©┤)ļŖ║╔öĄ(sh©┤)║¾Š═│╔×ķļxūėĘ¹╠¢(h©żo)�����ĪŻ└²╚ń“Na+”Š═▒Ē╩ŠŌcįŁūė╩¦╚źę╗éĆ(g©©)ļŖūė║¾│╔×ķĦę╗éĆ(g©©)å╬╬╗š²ļŖ║╔Ą─Ōcļxūė����Ż¼“ Mg2+”▒Ē╩ŠµVįŁūė╩¦╚źā╔éĆ(g©©)ļŖūė║¾│╔×ķĦā╔éĆ(g©©)å╬╬╗Ą─µVļxūė�Ż¼“O2-”▒Ē╩Šč§įŁūė½@Ą├ā╔éĆ(g©©)ļŖūė║¾│╔×ķĦā╔éĆ(g©©)å╬╬╗žō(f©┤)ļŖ║╔Ą─č§ļxūėĪŻ
ĪĪĪĪ1869─ĻęįŪ░����Ż¼┐ŲīW(xu©”)╝ęęčĮø(j©®ng)Ļæ└m(x©┤)░l(f©Ī)¼F(xi©żn)┴╦63ĘNį¬╦žŻ¼▀@ą®į¬╦žų«ķg╦Ų║§ø](m©”i)ėą╚╬║╬┬ō(li©ón)ŽĄ��Ż¼║├Ž±╗ź▓╗ŽÓĖ╔��ĪŻ
ĪĪĪĪČĒć°(gu©«)┐ŲīW(xu©”)╝ęķT(m©”n)Į▌┴ąĘ“(Dmitry Ivanovich Mendeleev,1834Ī½1907)į┌Ū░╚╦╣żū„Ą─╗∙ĄA(ch©│)╔Ž�Ż¼ī”(du©¼)į¬╦ž╝░Ųõąį┘|(zh©¼)▀M(j©¼n)ąą┴╦ŽĄĮy(t©»ng)Ą─蹊┐����Ż¼╦¹īó«ö(d©Īng)Ģr(sh©¬)ęčų¬Ą─63ĘNį¬╦žę└ō■(j©┤)ŽÓī”(du©¼)įŁūė┘|(zh©¼)┴┐┤¾ąĪęÄ(gu©®)┬╔▀M(j©¼n)ąą┼┼┴ą�����Ż¼ųŲ│╔Ą─▒ĒĖ±│╔×ķ¼F(xi©żn)┤·į¬╦žų▄Ų┌▒ĒĄ─ļrą╬����ĪŻ└¹ė├ų▄Ų┌▒Ē�����Ż¼ķT(m©”n)Į▌┴ąĘ“│╔╣”ŅA(y©┤)£y(c©©)┴╦«ö(d©Īng)Ģr(sh©¬)╔ą╬┤░l(f©Ī)¼F(xi©żn)Ą─į¬╦ž(µē���ĪóŌé��ĪóµN)��ĪŻ
ĪĪĪĪ1913─Ļėóć°(gu©«)┐ŲīW(xu©”)╝ę─¬╔½└š└¹ė├ĻÄśO╔õŠĆū▓ō¶Įī┘«a(ch©Żn)╔·X╔õŠĆ���Ż¼░l(f©Ī)¼F(xi©żn)įŁūėą“öĄ(sh©┤)įĮ┤¾Ż¼X╔õŠĆĄ─Ņl┬╩Š═įĮĖ▀����Ż¼ę“┤╦╦¹šJ(r©©n)×ķ║╦Ą─š²ļŖ║╔öĄ(sh©┤)øQČ©┴╦į¬╦žĄ─╗»īW(xu©”)ąį┘|(zh©¼)��Ż¼▓ó░čį¬╦žę└šš║╦ā╚(n©©i)š²ļŖ║╔öĄ(sh©┤)(╝┤┘|(zh©¼)ūėöĄ(sh©┤))┼┼┴ą�Ż¼Įø(j©®ng)▀^(gu©░)ČÓ─Ļą▐ėå║¾▓┼│╔×ķ«ö(d©Īng)┤·Ą─ų▄Ų┌▒Ē���ĪŻ
ĪĪĪĪļSų°╚╦éāī”(du©¼)į¬╦žĄž▀M(j©¼n)ę╗▓ĮšJ(r©©n)ūR(sh©¬)����Ż¼į¬╦žų▄Ų┌▒ĒĄ├ĄĮ┴╦═Ļ╔Ų����Ż¼¼F(xi©żn)į┌į¬╦žų▄Ų┌▒ĒęčĮø(j©®ng)│╔×ķ╚╦éā蹊┐╗»īW(xu©”)Īó蹊┐╬’┘|(zh©¼)Ą─ę╗éĆ(g©©)▒žéõĄ─╣żŠ▀����ĪŻ
ĪĪĪĪį┌╗»īW(xu©”)īW(xu©”)┐ŲŅI(l©½ng)ė“ųą╩╣ė├Ą─į¬╦žų▄Ų┌▒Ē╠ß╣®Ą─ą┼ŽóĖ³═╗│÷┴╦į¬╦žĄ─įŁūėĮY(ji©”)śŗ(g©░u)ą┼ŽóĪŻ
ĪĪĪĪį¬╦žų▄Ų┌▒Ēųą¼F(xi©żn)╩šõø112ĘNį¬╦ž��ĪŻį¬╦žėąČÓĘNĘųŅÉĘĮ╩Į�Ż¼░┤ĮM│╔å╬┘|(zh©¼)ąį┘|(zh©¼)Ą─▓╗═¼┐╔ęįĘų×ķĮī┘į¬╦ž║═ĘŪĮī┘į¬╦žĪŻ╚ńŌc��ĪóµV���ĪóõXĄ╚╩ŪĮī┘į¬╦ž����Ż¼ę╗░Ńė├“Ņ─”ū„Ų½┼į;Č°╠╝Īóč§��ĪóõÕĄ╚×ķĘŪĮī┘į¬╦ž��Ż¼ę╗░Ńęį“╩»”���Īó“ÜŌ”Īó“Ń▀”ū„Ų½┼į�����ĪŻÅ─į¬╦žĄ─Ų½┼į▓╗Ą½┐╔ęį┐┤│÷╩ŪĮī┘į¬╦ž▀Ć╩ŪĘŪĮī┘į¬╦ž��Ż¼▀Ć┐╔ęį┐┤│÷▀@ą®į¬╦žĄ─å╬┘|(zh©¼)į┌│Ż£ž│Żē║Ž┬Ą─ĀŅæB(t©żi)�����Ż¼ę╗░Ńęį“╩»”×ķŲ½┼įĄ─å╬┘|(zh©¼)į┌│Ż£ž│Żē║Ž┬×ķ╣╠¾w�Ż¼ęį“ÜŌ”×ķŲ½┼įĄ─å╬┘|(zh©¼)×ķÜŌ¾wŻ¼Č°ęį“Ń▀”×ķŲ½┼įĄ─å╬┘|(zh©¼)×ķę║¾w�Ż¼Å─▀@ą®ęŌ┴x╔Ž┐┤���Ż¼į¬╦žĄ─ųą╬─├¹ĘQ▒╚į¬╦žĘ¹╠¢(h©żo)ČÓ│÷Ė³ČÓĄ─║Ł┴xŻ¼▀@╚½ę¬?d©▓)w╣”ė┌┐ŲīW(xu©”)╝ęąņē█��ĪŻ
ĪĪĪĪ┘Y┴Ž┐©Ų¼ĪĪąņē█(1818.2.26Ī½1884.9.24)ūųč®▀Ś���Ż¼╠¢(h©żo)╔·į¬���Ż¼╩Ū╬ęć°(gu©«)Į³┤·╗»īW(xu©”)Ą─åó├╔š▀Ż¼19╩└╝o(j©¼)60─Ļ┤·����Ż¼į┌╬ęć°(gu©«)ŽĄĮy(t©»ng)ĮķĮB┴╦Į³┤·╗»īW(xu©”)Ą─╗∙ĄA(ch©│)ų¬ūR(sh©¬)ĪŻį┌ąņē█╔·╗ŅĄ──Ļ┤·�Ż¼╬ęć°(gu©«)▓╗āHø](m©”i)ėą═Ō╬─ūųĄõŻ¼╔§ų┴▀B░ó└Ł▓«?d©Īng)?sh©┤)ūųę▓ø](m©”i)ėą��Ż¼ę¬░č╬„ĘĮ┐ŲīW(xu©”)╝╝ąg(sh©┤)Ą─ąg(sh©┤)šZ(y©│)ė├ųą╬─▒Ē▀_(d©ó)│÷üĒ(l©ói)╩ŪĒŚ(xi©żng)ķ_(k©Īi)äō(chu©żng)ąįĄ─╣żū„����Ż¼ū÷ŲüĒ(l©ói)īŹ(sh©¬)į┌╩Ū└¦ļyųžųžĪŻ╬„ĘĮĄ─Ų┤ę¶╬─ūų║═╬ęć°(gu©«)Ą─ĘĮēKØhūų��Ż¼į┌įņūųįŁät╔ŽėąśO┤¾▓╗═¼Ż¼Äū║§╚½▓┐Ą─╗»īW(xu©”)ąg(sh©┤)šZ(y©│)║═┤¾▓┐Ęų╗»īW(xu©”)į¬╦žĄ─├¹ĘQ��Ż¼į┌Øhūų└’ø](m©”i)ėą¼F(xi©żn)│╔Ą─├¹ĘQ���Ż¼▀@┐╔─▄╩Ūąņē█į┌ūgĢ°(sh©▒)ųąė÷ĄĮĄ─ūŅ┤¾└¦ļy����Ż¼×ķ┤╦ąņē█╗©┘M(f©©i)┴╦▓╗╔┘ą─č¬��ĪŻī”(du©¼)Į�ĪóŃyĪóŃ~�����ĪóĶF�����ĪóÕa�����Īó┴“�����Īó╠╝╝░B(y©Żng)ÜŌ(Į±ūgč§ÜŌ)�Īó▌pÜŌ(Į±ūgÜõÜŌ)ĪóŠGÜŌ(Į±ūg┬╚ÜŌ)�����ĪóĄŁÜŌ(Į±ūgĄ¬?d©▓)?Ą╚┤¾╝ęęč▌^╩ņŽżĄ─į¬╦ž��Ż¼╦¹čžė├Ū░ųŲ�����Ż¼Ė∙ō■(j©┤)╦³éāĄ─ų„ꬹį┘|(zh©¼)üĒ(l©ói)├³├¹�����ĪŻī”(du©¼)ė┌Ųõ╦¹į¬╦ž���Ż¼ąņē█Ū╔├ŅĄžæ¬(y©®ng)ė├┴╦╚Ī╬„╬─Ą┌ę╗ę¶╣Ø(ji©”)Č°įņą┬ūųĄ─įŁätüĒ(l©ói)├³├¹�����Ż¼└²╚ńŌc��ĪóŌø�ĪóŌ}ĪóµćĄ╚��ĪŻąņē█▓╔ė├Ą─▀@ĘN├³├¹ĘĮĘ©�����Ż¼║¾üĒ(l©ói)▒╗╬ęć°(gu©«)╗»īW(xu©”)ĮńĮė╩▄��Ż¼ę╗ų▒čžė├ų┴Į±��ĪŻ
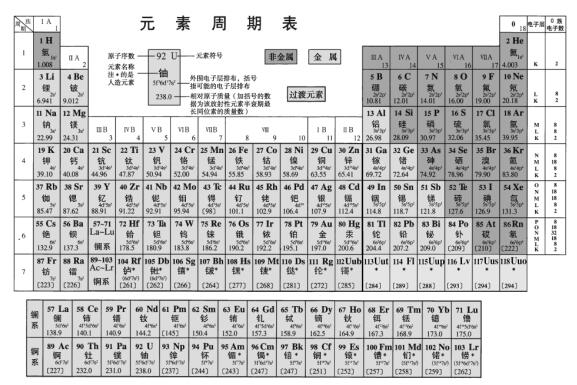
ĪĪĪĪ═©│Ż╬ęéā▀Ć┐╔ęįĖ∙ō■(j©┤)į¬╦ž║¼┴┐Ą─ČÓ╔┘���Ż¼░čį¬╦žĘų×ķ│Ż┴┐į¬╦ž║═╬ó┴┐į¬╦ž;Ė∙ō■(j©┤)į¬╦žĄ─üĒ(l©ói)į┤���Ż¼┐╔ęįĘų×ķūį╚╗Įńųą┤µį┌Ą─į¬╦ž║═╚╦╣ż║Ž│╔Ą─į¬╦ž;Ė∙ō■(j©┤)į¬╦žįŁūė╩ŪʱŠ▀ėąĘ┼╔õąįŻ¼Ęų×ķĘ┼╔õąįį¬╦ž║═ĘŪĘ┼╔õąįį¬╦žĄ╚Ą╚���ĪŻ
ĪĪĪĪę╗ĘNį¬╦ž┐╔ęį┤µį┌ė┌▓╗═¼Ą─╬’┘|(zh©¼)ųą�����Ż¼╚ń╦«ĪóČ■č§╗»╠╝Īó╔·╩»╗ę���Īó╩»╗ę╩»ųąČ╝┤µį┌č§į¬╦ž��Ż¼Č°č§ÜŌ���Īó│¶č§ę▓╩Ūė╔č§į¬╦žĮM│╔Ą─Ż¼į┌Ū░ę╗ŅÉ╬’┘|(zh©¼)ųąč§Č╝║═Ųõ╦¹į¬╦ž╣▓┤µ����Ż¼ę▓Š═╩Ū┤µį┌ė┌╗»║Ž╬’ųą;║¾ę╗ŅÉ╬’┘|(zh©¼)ųąų╗┤µį┌č§ę╗ĘNį¬╦žŻ¼ę▓Š═╩Ū┤µį┌ė┌å╬┘|(zh©¼)ųą���ĪŻ═©│Ż�Ż¼╬ęéā░č╗»║Ž╬’ųąį¬╦žĄ─ĀŅæB(t©żi)ĘQ×ķ╗»║ŽæB(t©żi)�Ż¼░čå╬┘|(zh©¼)ųąĄ─į¬╦žĀŅæB(t©żi)ĘQ×ķė╬ļxæB(t©żi)Ż¼Į^┤¾▓┐Ęųį¬╦žį┌ūį╚╗ĮńųąČ╝ėąā╔ĘN┤µį┌ą╬æB(t©żi)�Ż¼ėąą®į¬╦žį┌ūį╚╗Įńųąų╗┤µį┌╗»║ŽæB(t©żi)Ż¼ø](m©”i)ėąė╬ļxæB(t©żi)��Ż¼╚ńŌcį¬╦žų„ę¬ęįNa2CO3�ĪóNaClĄ╚╗»║Ž╬’Ą─ą╬╩Į┤µį┌Ż¼į┌ūį╚╗Įńųąø](m©”i)ėąå╬┘|(zh©¼)Ōc�ĪŻ╩│¹}ųąĄ─┬╚į¬╦ž�Ż¼ę▓╩Ūų╗ėą╗»║ŽæB(t©żi)ø](m©”i)ėąė╬ļxæB(t©żi)���Ż¼ę“?y©żn)ķ┬╚ÜŌąį┘|(zh©¼)▀^(gu©░)ė┌╗ŅØŖ�Ż¼¤o(w©▓)Ę©į┌ūį╚╗Śl╝■Ž┬║═Ųõ╦¹╬’┘|(zh©¼)║═ųCŽÓ╠Ä�ĪŻ
ĪĪĪĪę╗░ŃüĒ(l©ói)šf(shu©Ł)��Ż¼Įī┘į¬╦žŠ▀ėąĮī┘ąį����Ż¼ĘŪĮī┘į¬╦žŠ▀ėąĘŪĮī┘ąįŻ¼╬╗ė┌ų▄Ų┌▒ĒųąĮī┘┼cĘŪĮī┘Į╗Įń╠ÄĄ─į¬╦ž��Ż¼═∙═∙╝╚ėąĮī┘ąįėųėąĘŪĮī┘ąį���ĪŻ╦∙ų^į¬╦žĮī┘ąį��Ż¼═©╦ūĄ─ųv��Ż¼Š═╩ŪŲõå╬┘|(zh©¼)ę╗░ŃėąĮī┘╣ŌØ╔�Īó┴╝║├Ą─ī¦(d©Żo)ļŖąį�����Īóī¦(d©Żo)¤ßąį║═čėš╣ąįĄ╚╬’└Ē═©ąį;Č°ŲõįŁūėį┌╗»īW(xu©”)ūā╗»ųąŻ¼ę╗░ŃŠ▀ėą╩¦╚źļŖūėĄ─āAŽ“��ĪŻ
ĪĪĪĪ[Žļę╗Žļ]ĪĪ1.«ŗ(hu©ż)│÷Ōc�����ĪóµVĄ─įŁūėĮY(ji©”)śŗ(g©░u)╩ŠęŌłD�����ĪŻėą╚╦šJ(r©©n)×ķµVįŁūė─▄╩¦╚ź2éĆ(g©©)ļŖūė�Ż¼Č°ŌcįŁūėų╗─▄╩¦╚ź1éĆ(g©©)ļŖūė�Ż¼╦∙ęįµVĄ─Įī┘ąį▒╚ŌcÅŖ(qi©óng)���Ż¼─Ń═¼ęŌ▀@ĘNė^³c(di©Żn)åß?
ĪĪĪĪ╩┬īŹ(sh©¬)╔ŽĮī┘į¬╦žįŁūėĄ─ūŅ═ŌīėļŖūėöĄ(sh©┤)ę╗░ŃČ╝▌^╔┘(≤3)Ż¼×ķ┴╦▀_(d©ó)ĄĮŅÉ╦ŲŽĪėąÜŌ¾wĄ─ŽÓī”(du©¼)ĘĆ(w©¦n)Č©ĮY(ji©”)śŗ(g©░u)�����Ż¼╦³éā═∙═∙Č╝Ģ■(hu©¼)▀xō±╩¦╚źūŅ═ŌīėļŖūėŻ¼į¬╦žĄ─▀@ĘNąį┘|(zh©¼)Š═╩Ū╦∙ų^Ą─Įī┘ąįĪŻ▓╗═¼į¬╦žĄ─įŁūė╩¦╚źūŅ═ŌīėļŖūėĄ──▄┴”▓╗═¼��Ż¼įĮ╚▌ęū╩¦╚źūŅ═ŌīėļŖūėĄ─Įī┘�����Ż¼Ųõį¬╦žĄ─Įī┘ąįŠ═įĮÅŖ(qi©óng)�Ż¼ī”(du©¼)æ¬(y©®ng)Ą─Įī┘å╬┘|(zh©¼)ę▓Š═įĮ╗ŅØŖ�����ĪŻ╚ńĮī┘╗Ņäė(d©░ng)Ēśą“▒ĒųąK┼┼į┌NaĄ─Ū░├µ�Ż¼Š═ęŌ╬Čų°K▒╚Na╗ŅØŖ���Ż¼K▒╚Na╚▌ęū╩¦╚źūŅ═ŌīėļŖūė�����Ż¼Ōøį¬╦žĄ─Įī┘ąįŠ═▒╚Ōcį¬╦žĄ─Įī┘ąįÅŖ(qi©óng)���ĪŻ
ĪĪĪĪ[Žļę╗Žļ]ĪĪ2.«ŗ(hu©ż)│÷č§��Īó┴“Ą─įŁūėĮY(ji©”)śŗ(g©░u)╩ŠęŌłD����Ż¼Å─ĮY(ji©”)śŗ(g©░u)╔Žšf(shu©Ł)├„č§į¬╦žĘŪĮī┘ąį▒╚┴“į¬╦žÅŖ(qi©óng)Ą─įŁę“�ĪŻ
ĪĪĪĪĘŪĮī┘į¬╦žĄ─įŁūėūŅ═ŌīėļŖūėöĄ(sh©┤)ę╗░ŃČ╝▌^ČÓ(≥4)Ż¼×ķ┴╦▀_(d©ó)ĄĮŅÉ╦ŲŽĪėąÜŌ¾wĄ─ŽÓī”(du©¼)ĘĆ(w©¦n)Č©ĮY(ji©”)śŗ(g©░u)�Ż¼╦³éā═∙═∙Č╝Ģ■(hu©¼)▀xō±Ą├ĄĮļŖūėŻ¼į¬╦žĄ─▀@ĘNąį┘|(zh©¼)Š═╩Ū╦∙ų^Ą─ĘŪĮī┘ąį����ĪŻ▓╗═¼ĘŪĮī┘į¬╦žĄ─įŁūėĄ├ļŖūė─▄┴”▓╗═¼Ż¼įĮ╚▌ęūĄ├ĄĮļŖūėĄ─ĘŪĮī┘�Ż¼į¬╦žĄ─ĘŪĮī┘ąįŠ═įĮÅŖ(qi©óng)Ż¼ī”(du©¼)æ¬(y©®ng)Ą─ĘŪĮī┘å╬┘|(zh©¼)ę▓Š═įĮ╗ŅØŖ�����ĪŻ╚ńFĄ─ĘŪĮī┘ąį▒╚ClÅŖ(qi©óng)��Ż¼F(xi©żn)įŁūė▒╚ClįŁūė╚▌ęūĄ├ĄĮļŖūėŻ¼Ę·ÜŌ▒╚┬╚ÜŌĖ³╗ŅØŖ�����Ż¼ę╗░ŃŚl╝■Ž┬��Ż¼╬ęéā║▄ļyųŲéõ▓ó▒Ż┤µĘ·ÜŌ����ĪŻ
ĪĪĪĪį¬╦žĄ─Įī┘ąį║═ĘŪĮī┘ąįę▓┐╔ęįęį╗»║Žār(ji©ż)¾w¼F(xi©żn)���ĪŻ«ö(d©Īng)į¬╦ž╠Äė┌ė╬ļxæB(t©żi)Ģr(sh©¬)Ųõ╗»║Žār(ji©ż)×ķ┴Ń����Ż¼«ö(d©Īng)į¬╦ž╠Äė┌╗»║ŽæB(t©żi)Ģr(sh©¬)Ųõ╗»║Žār(ji©ż)Š═ėąš²�����Īóžō(f©┤)ų«Ęų���Ī��Ż╗»║Ž╬’ųąś╦(bi©Īo)Č©į¬╦žĄ─╗»║Žār(ji©ż)ę¬ū±čŁęįŽ┬įŁätŻ║
ĪĪĪĪ(1)╗»║Ž╬’ųąį¬╦žĄ─š²žō(f©┤)╗»║Žār(ji©ż)┐éöĄ(sh©┤)ŽÓĄ╚���ĪŻ▀@╩Ū┤_Č©╗»║Žār(ji©ż)Ą─ūŅ╗∙▒ŠĄ─įŁät�Ż¼į┌╗»║Ž╬’MnO2ųą���Ż¼Oį¬╦ž│╩¼F(xi©żn)-2ār(ji©ż)�����Ż¼Ė∙ō■(j©┤)╩ž║ŃįŁät┐╔┤_Č©ČÓār(ji©ż)æB(t©żi)Įī┘M(f©©i)n│╩¼F(xi©żn)+4ār(ji©ż)�ĪŻ
ĪĪĪĪ(2)Įī┘¤o(w©▓)žō(f©┤)ār(ji©ż)(į┌╗»║Ž╬’ųąČ╝│╩¼F(xi©żn)š²ār(ji©ż))��Ż¼Ōc���ĪóµV����ĪóõXĄ╚│ŻęŖ(ji©żn)Įī┘Ą─ār(ji©ż)æB(t©żi)╩Ū╬©ę╗Ą─��ĪŻį┌╗»║Ž╬’AlNųą�Ż¼╬ęéāų¬Ą└Alų╗ėą+3ār(ji©ż)�����Ż¼ät║▄╚▌ęū═Ų│÷N│╩¼F(xi©żn)-3ār(ji©ż);į┌╗»║Ž╬’NaHųąŻ¼Na│╩¼F(xi©żn)+1ār(ji©ż)Ż¼ätH×ķ-1ār(ji©ż);į┌╗»║Ž╬’Na2O2ųą���Ż¼Na│╩¼F(xi©żn)+1ār(ji©ż)����Ż¼ätO×ķ-1ār(ji©ż)����ĪŻ
ĪĪĪĪ(3)ā╔ĘNĘŪĮī┘į¬╦ž╗»║ŽĢr(sh©¬)ĘŪĮī┘ąįÅŖ(qi©óng)Ą─’@╩Šžō(f©┤)ār(ji©ż)ĪŻļm╚╗╬ęéā¼F(xi©żn)į┌▀Ć▓╗Ģ■(hu©¼)╚ź▒╚▌^ĘŪĮī┘ąįĄ─ÅŖ(qi©óng)╚§����Ż¼Ą½į┌╦∙ėąĘŪĮī┘Üõ╗»╬’ųąHČ╝│╩¼F(xi©żn)+1ār(ji©ż)���Ż¼Č°č§╗»╬’ųąOČ╝│╩¼F(xi©żn)žō(f©┤)ār(ji©ż)�Ż¼ų¬Ą└▀@ą®ėą└¹ė┌ś╦(bi©Īo)Č©Ė„ĘN╗»║Ž╬’ųąį¬╦žār(ji©ż)æB(t©żi)���Ż¼└²╚ńŻ║╗»║Ž╬’NH3ųą�����Ż¼H│╩¼F(xi©żn)+1ār(ji©ż)�����Ż¼ätN│╩¼F(xi©żn)-3ār(ji©ż);╗»║Ž╬’SiO2ųą�Ż¼O│╩¼F(xi©żn)-2ār(ji©ż)Ż¼ätSi×ķ+4ār(ji©ż)�ĪŻ
ĪĪĪĪ(4)│ŻęŖ(ji©żn)į¬╦žĄ─ūŅĖ▀ār(ji©ż)▓╗Ė▀ė┌ŲõįŁūėĄ─ūŅ═ŌīėļŖūėöĄ(sh©┤)Ż¼ūŅĄ═ār(ji©ż)▓╗Ą═ė┌ūŅ═ŌīėļŖūėöĄ(sh©┤)-8�ĪŻ
ĪĪĪĪšŲ╬š▀@éĆ(g©©)įŁätŻ¼Š═▓╗Ģ■(hu©¼)│÷¼F(xi©żn)üyś╦(bi©Īo)ār(ji©ż)æB(t©żi)Ą─¼F(xi©żn)Ž¾�ĪŻ╚ńSįŁūėūŅ═Ōīėėą6éĆ(g©©)ļŖūėŻ¼╦∙ęįSūŅĖ▀×ķ+6ār(ji©ż)�����Ż¼ūŅĄ═×ķ-2ār(ji©ż)���Ż¼į┌╗»║Ž╬’Cu2Sųą�Ż¼╚¶Cu×ķ+2ār(ji©ż)���Ż¼ätS¾w¼F(xi©żn)-4ār(ji©ż)��Ż¼Š═┼c╩┬īŹ(sh©¬)▓╗Ę¹�����Ż¼╦∙ęįCuŠ═ų╗─▄×ķ+1ār(ji©ż)����Ż¼Č°S¾w¼F(xi©żn)-2ār(ji©ż)ĪŻ
ĪĪĪĪ[įćę╗įć]ĪĪšł(q©½ng)ś╦(bi©Īo)│÷Ž┬┴ą╬’┘|(zh©¼)ųą╝ėų°ųž╠¢(h©żo)Ą─į¬╦žĄ─╗»║Žār(ji©ż)����ĪŻ
ĪĪĪĪNH3ĪóH2SO3��ĪóK2CrO4��ĪóKMnO4�ĪóFeSĪóCu2O��Īó
ĪĪĪĪKClO3�����ĪóNH4NO3��ĪóNa3N��ĪóHClO����ĪóH2O2ĪóP4�����Īó
ĪĪĪĪMgSO4����ĪóNaAlO2ĪóCaH2����ĪŻ
ĪĪĪĪū±čŁŽ╚║å(ji©Żn)å╬║¾Å═(f©┤)ļsĄ─╗∙▒Š╦╝ŽļŻ¼ę╗░ŃŽ╚ś╦(bi©Īo)Č©ų╗ėąå╬ę╗╗»║Žār(ji©ż)Ą─į¬╦ž�Ż¼╗»║Žār(ji©ż)ĘNŅÉįĮČÓĄ─į¬╦žįĮį┌║¾ś╦(bi©Īo)Č©ĪŻį┌Å═(f©┤)ļs╗»║Ž╬’ųąś╦(bi©Īo)Č©╗»║Žār(ji©ż)Ą─╗∙▒ŠĒśą“?y©żn)ķå╬ę╗ār(ji©ż)æB(t©żi)Įī┘(K����ĪóCaĪóNa��ĪóMg�ĪóAlĪóZnĄ╚)→H→O→Ųõ╦¹ĘŪĮī┘╗“ČÓār(ji©ż)æB(t©żi)Įī┘���ĪŻī”(du©¼)ė┌▓╗║¼å╬ę╗ār(ji©ż)æB(t©żi)Įī┘����Ż¼ę▓▓╗║¼H║═OĄ─╗»║Ž╬’Ż¼ę╗░ŃČ╝ę¬ę└ō■(j©┤)ęÄ(gu©®)ät(4)ĮŌøQå¢(w©©n)Ņ}�ĪŻ╗»║Ž╬’FeS2ųą���Ż¼╚¶Fe│╩+3ār(ji©ż)��Ż¼ätS×ķ-1.5ār(ji©ż)��Ż¼ę╗░Ńį¬╦žār(ji©ż)æB(t©żi)¤o(w©▓)ąĪöĄ(sh©┤)����Ż¼▓╗│╔┴ó;╚¶Fe│╩+2ār(ji©ż)�Ż¼
ĪĪĪĪätS’@-1ār(ji©ż)Ī���Ż╗»║Ž╬’Na2FeO4ųą���Ż¼Ž╚Na║¾Oį┘Fe���Ż¼Na×ķ+1ār(ji©ż)����Ż¼O×ķ-2ār(ji©ż)Ż¼Ė∙ō■(j©┤)╗»║Žār(ji©ż)┤·öĄ(sh©┤)║═×ķ0┐╔Ū¾Ą├Fe×ķ+6ār(ji©ż)�����ĪŻ
ą┬│§╚²┐ņÆ▀┤aĻP(gu©Īn)ūó
ųą┐╝ŠW(w©Żng)╬óą┼╣½▒Ŗ╠¢(h©żo)
├┐╚š═Ų╦═īW(xu©”)┴Ģ(x©¬)╝╝Ū╔����Ż¼īW(xu©”)┐Ųų¬ūR(sh©¬)³c(di©Żn)
ų·─ŃėŁĮė2020─Ļųą┐╝ŻĪ
ĪĪĪĪ ÜgėŁ╩╣ė├╩ųÖC(j©®)���ĪóŲĮ░ÕĄ╚ęŲäė(d©░ng)įO(sh©©)éõįLå¢(w©©n)ųą┐╝ŠW(w©Żng)�����Ż¼2023ųą┐╝ę╗┬Ę┼Ń░ķ═¼ąą���ŻĪ>>³c(di©Żn)ō¶▓ķ┐┤