1F
ﺟﺙﮰc(di۷۲n)ﺻﭨ۲ﭦﺛﻭﻋﺎﺥﭼﺵ
(ﺻﭨ)���۰۱ﺙﺛﻭﻋﺎﺥﭼﺵ۲ﭦﺙﺛﻭﻋ(90ﭘﻓﺓN)

(ﭘﹼ)��۰۱ﭦﺵﺛﻭ(ﻉﮄ۶ﺓN)۲ﭦﺽﺭﺻﭨﺓNﺛﻭﻋﺕﻲﺩﻛﺯﻳﺻﭨﺓNﭨﮨﻉﺓNﺛﻭﻋ(ﭨﮨﺛﻭﻋﺧcﺓﮄﺛﻭﻋ)ﺻﭨﺩﻭﺫﻍﭦﺵﭘﺋﺏﺭﭖﺥﺝﻑﺽﺷﺛﻭﻋﮊﻊﺷﺿﭖﺥﺳﺅﻋ|(zh۷؛)���۰۲
1. ﺛﻭﻋﺎﺥﭼﺵﺍﮰﭺ۷ﺙﺛﻭﻋﭦﺱﭦﺵﺛﻭﺭﻧ۰۲ﺛﻭﻋﻋﺽﻌﺛﻭﻋﺎﺥﭼﺵ�����۲؛ﭖ،ﺛﻭﻋﺎﺥﭼﺵﺎﭨﺻﭨﭘ۷ﮌﮄﺙﺛﻭﻋ�����۲؛ﺻﺎﺟﺭﺥﻎﮌﮄﭦﺵﺛﻭ۰۲
2. ﭦﺵﺛﻭﺟﺭﺥﻎﮌﮄﺛﻭﻋﺧcﺛﻭﻋﺛMﺏﺭ��۲؛ﺻﺎﺟﺭﺥﻎﮌﮄﺛﻭﻋﺧcﺓﮄﺛﻭﻋﺛMﺏﺭ���۰۲ﺛﻭﻋﺎﺥﭼﺵﻅﺷﮌﺗﺽﺣﺎﺫﻏ^Vﺓﭦﭖﺥﮌﮄﭦﺵﺛﻭ�����۰۲
ﭦﺵﺛﻭﭖﺥ(y۷u)ﮰc(di۷۲n)۲ﭦ
(1)ﺫﻍﮰc(di۷۲n)ﺕﻑ�۰۱ﺣﻎﭘﺫﺷ۰;(2)ﺟﺭﺯﻎﺷﺿﭦﺣ�����۰۱ﺻﻉﺽﻌﺙﺽﺗ۳���۰۱C(j۷۸)ﺷﭖﺷﺿﺥﻎﭦﺣ;(3)ﺟﺗﺕﺁﺳgﺷﺿﺥﻎﭦﺣ;
ﺵﺡﺣﮔﮌﮄﮰSﻙ~ﭦﺱﻙ~ﺩ؛�۲؛ﭦﺕﮒaﭦﺱﮒa�۲؛ﻛXﭦﺵﺛﻭﭦﺱﻛXﺝﭖﺥﺽﺷﻡP(gu۷۰n)ﺷﺿﻋ|(zh۷؛)ﺎﺫﻏ^۲ﭦ
ﻗﭦﺵﺛﻭﭖﺥ(y۷u)ﮰc(di۷۲n)۲ﭦ۱ﻋ ﺫﻍﮰc(di۷۲n)ﺕﻑ۰۱ﺣﻎﭘﺫﺷ��۰�۲ﭨ۱ﻌ ﺟﺭﺯﻎﺷﺿﭦﺣ�����۰۱ﺻﻉﺽﻌﺙﺽﺗ۳�۰۱C(j۷۸)ﺷﭖﺷﺿﺥﻎﭦﺣ�۲ﭨ۱ﻍ ﺟﺗﺕﺁﺳgﺷﺿﺥﻎﭦﺣ
ﻗﭦﺱﻗﭦﺵﺛﻭ۲ﭦﺎﭨﻁJ(r۷۷n)ﻠﮌﮄ21ﮌﭺﺙo(j۷؛)ﭖﺥﻅﻊﺻ۹ﺛﻭﻋﺎﺥﭼﺵ۲؛ﻗﭦﺵﺛﻭﺧcﺫﺯﮩwﺽﺷﭦﻎﭦﺣﭖﺥ“ﺵﻓﺫﻏﺷﺿ”�����۲؛ﺻﮨﺑﺯﺟﺭﺽﺣﻥ(l۷۱i)ﻅﺩﺿﮞﺫﺯﺿﮞﺗﮄﭖﺫ�����۰۲
ﻗﮔﭦﺵﺛﻭﺝﻑﺽﺷ“ﺽ”ﺥﻎﭼ۵���۲؛ﺟﺭﺽﻉ۰ﺥﺏ(g۷۷)ﮊﻊﭘ۷ﻊﭘﺫﺵﺡﭖﺥﺷﺳ ﻧ�۲؛ﻅﭨﺻ۹ﺱ(f۷ﺑ)ﭨﻊﻑ@(g۷۷)ﻊﭘﺫ�۲؛ﺝﺱﹼ(hu۷؛)ﭨﻅﺱ(f۷ﺑ)ﭖﺛﻑ@(g۷۷)ﻊﭘﺫﺵﺡﭖﺥﺷﺳ ﻧ��۲؛ﺽﻅﺎﭨﺓQﻠ“ﺽﺛﻭﻋ”���۰۲ﺑﺯﺱﻗ��۲؛ﻗﻑﺟﺭﻅﺩﺫ۰ﺏ؛۶(d۷۲o)ﺎﺥﭼﺵ���۲؛ﺣﭺﺋ(gu۷؟)ﺭﻲ؟a(ch۷۲n)ﭖﺥﺏ؛۶(d۷۲o)ﺎﺥﭼﺵﻅﺷﭖﺥ90%ﮌﮄﺽﺣﻗﻗﭦﺵﺛﻭﻅﺩﺿﮞﭖﺥ�����۰۲
3. ﻉ۱ﺻﻗ۲ﭦ(1)ﭦﺵﺛﻭﮌﮄﺛﻭﻋﺧcﺛﻭﻋﭨﮨﺛﻭﻋﺧcﺓﮄﺛﻭﻋﭖﺥﭨﮞﭦﺵﺳﺅ�����۰۲(2)ﭦﺵﺛﻭﭖﺥﭦﻎﭘﻓﺷﺿﺥﻎﺧcﺛMﺏﺭﺯﮰﭖﺥﺙﺛﻭﻋﺎﭨﺱ؛�۲؛ﮌﺗﭦﺵﺛﻭﺕﮰﺫﻏﺻﻉﻑmﺽﻌﺎﭨﺱ؛ﭖﺥﺽﺣﺱﺝ�����۰۲(3)ﺫﻁﺏ۲ﮌﺗﺽﺣﭖﺥﺛﻭﻋﺎﺥﭼﺵ���۲؛ﺑﮩﭘﻓﭖ(sh۷ﺑ)ﻠﭦﺵﺛﻭ��۰۲(4)ﺛﻭﻋﺿﻌﺫﻍﭦﺵﭼﺯﺩﻛﺯﮰﺛﻭﻋﭦﺱﺓﮄﺛﻭﻋﭦﮩ�����۲؛ﺎﭨHﺛMﺏﺭﺭﺵﺍl(f۷۰)ﺭﻲﭼﺯﻉﭨﺁ�����۲؛ﺩﻛﺫ(n۷۷i)ﺎﺟﺛMﺏﺭﺛY(ji۷۵)(g۷ﺍu)ﺻﺎﺍl(f۷۰)ﺭﻲﭼﺯﺕﺥﻉ�����۲؛ﺥﭘﺋﺻﮮﺩﻭﺷﺿﻋ|(zh۷؛)ﭖﺥﻉﭨﺁ�����۰۲
4. 2.ﭦﺵﺛﻭﭖﺥﺷﺳﺏﺭlﺙﹼ۲ﭦﺩﻛﻅﺷﺫﺳﺻﭨﺛﻭﻋﭖﺥﺫﻍﮰc(di۷۲n)ﺎﭨﺥﻎﺕﻑﺽﻌﭼﻥﺻﭨﺛﻭﻋﭖﺥﺓﺷﮰc(di۷۲n)(؟(d۷۰ng)ﺭﺓNﺛﻭﻋﺷﺳﺏﺭﭦﺵﺛﻭr(sh۷۹))�����۰۲
5. ﮄﻓﻙ~ﮌﮄﺫﺯﻧvﮌﺓﺭﺵﮌﺗﺽﺣﻉﻧﺿﻝﭖﺥﭦﺵﺛﻭ;ﺭﻲﻟFﭦﺱﻛﮌﮄﺫﺯﻧﭺﻳﺽﺣﻉﻧVﺓﭦﭖﺥﭦﺵﺛﻭ.
6. ﭦﺵﺛﻭﭘﺙﻋﺽﻌﭨﮞﭦﺵﺳﺅ��۰۲
2F
ﺟﺙﮰc(di۷۲n)2۲ﭦﺛﻭﻋﭖﺥﺳﺅﭺﻥﺷﺿﻋ|(zh۷؛)
(1)ﺏ۲ﻊﺵﺡﺻﭨﺍﻙﻠﺗﮊB(t۷۳i)(ﺗﺁﻠﺻﭦB(t۷۳i))�۲؛ﺽﺷﺛﻭﻋﺗﻗﺭ۰۲(2)ﺑﮩﭘﻓﭖ(sh۷ﺑ)ﺏﮌﻙyﺍﻉﺭ،(ﻙ~ﻠﻉﺵﺙtﺭ،��۲؛ﺛﻭﻠﮰSﺭ،)(3)ﺽﺷﭼﺙﭦﺣﭖﺥ۶(d۷۲o)ﻕﺷﺿ�۰۱۶(d۷۲o)ﻣﺷﺿ۰۱ﺹﺽﻁﺗﺷﺿ(4)ﺣﻎﭘﺫﭦﺱﺽﺎﭘﺫﻏ^ﺑﮩ���۲؛ﺫﻍﺓﺷﮰc(di۷۲n)ﻏ^ﺕﻑ�����۰۲ ﻉ۱۲ﭦﺛﻭﻋﭖﺥﺳﺅﭺﻥﺷﺿﻋ|(zh۷؛)ﮌﮄﻅﭨﺯﻱﺽﺷﺛﻭﻋﭘﺙﺽﺷﭖﺥﺗﺎﺱ؛ﺷﺿﻋ|(zh۷؛)�۲؛ﭘﺋﺎﭨﮌﮄﻅﺕﺥﺏﺻﭨﺛﻭﻋﭖﺥﮊﻊﺽﺷﺷﺿﻋ|(zh۷؛)���۰۲
3F
ﺟﺙﮰc(di۷۲n)3 ۲ﭦﺛﻭﻋﻅ؟ﻉﻧ
(1)ﻛX۲ﭦﭖﻊ۳ﻅﺷﭦ؛ﭼﺟﻉﻧﭘﻓﭖﺥﺛﻭﻋﺿ۹ﺯﻊ (2)ﻗ}۲ﭦﺫﺯﮩwﻅﺷﭦ؛ﭼﺟﻉﻧﭘﻓﭖﺥﺛﻭﻋﺿ۹ﺯﻊ(3)ﻟF۲ﭦﺥﺟﮄﺍﮌﭺﺛﻝﺥﻡ؟a(ch۷۲n)ﭼﺟﻉﻧﭘﻓﭖﺥﺛﻭﻋ(ﻟF>ﻛX>ﻙ~)(4)ﻙy۲ﭦ۶(d۷۲o)ﻣ���۰۱۶(d۷۲o)ﻕﺷﺿﻉﻧﭦﺣﭖﺥﺛﻭﻋ(ﻙy>ﻙ~>ﺛﻭ>ﻛX)(5)ﻙt۲ﭦﺽﺎﭘﺫﻉﻧﺕﻑﭖﺥﺛﻭﻋ (6)ﮔu۲ﭦﺫﻍﮰc(di۷۲n)ﻉﻧﺕﻑﭖﺥﺛﻭﻋ(7)ﺗﺁ۲ﭦﺫﻍﮰc(di۷۲n)ﻉﻧﭖﺱﭖﺥﺛﻭﻋ (8)ﻛ~۲ﭦﺣﻎﭘﺫﻉﻧﺑﮩﭖﺥﺛﻭﻋ(9)ﻛ ۲ﭦﺣﻎﭘﺫﻉﻧﺷ۰ﭖﺥﺛﻭﻋ
4F
ﺟﺙﮰc(di۷۲n)4۲ﭦﺛﻭﻋﺧcﺹﺀﻗﭖﺥﺓﺑ۹(y۷۸ng)
5F
ﺟﺙﮰc(di۷۲n)5۲ﭦﺛﻭﻋﺧcﺯﻕﭖﺥﺓﺑ۹(y۷۸ng)
6F
ﺟﺙﮰc(di۷۲n)6۲ﭦﻋﺧcﭨﺁﭦﺵﺳﺅﺫﻎﺻﭦﭖﺥﺓﺑ۹(y۷۸ng)
7F
ﺟﺙﮰc(di۷۲n) 7 ۲ﭦﻅﺣQﺓﺑ۹(y۷۸ng)
ﻅﺣQﺓﺑ۹(y۷۸ng)۲ﭦﺽﺭﺻﭨﺓNﺳﻋ|(zh۷؛)ﺧcﺻﭨﺓNﭨﺁﭦﺵﺳﺅﺓﺑ۹(y۷۸ng)۲؛ﺭﻲﺏﺭﭼﻥﺻﭨﺓNﺳﻋ|(zh۷؛)ﺧcﭨﺁﭦﺵﺳﺅﭖﺥﺓﺑ۹(y۷۸ng)ﺛﺷﻉﺉﻅﺣQﺓﺑ۹(y۷۸ng)�����۰۲
8F
ﺟﺙﮰc(di۷۲n)8 ۲ﭦﺛﻭﻋﭨﻧﺽ(d۷ﺍng)ﺷﺿﻥﺷﮨ
1�����۰۱ﺏ۲ﺻﺛﻭﻋﭖﺥﭨﻧﺽ(d۷ﺍng)ﺷﺿﻥﺷﮨ۲ﭦ
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
2���۰۱ﺻﻗﭼx۲ﭦ۱ﻋHﺑﻲﺎﻥﺯﻕﻅﺷﭖﺥﻛﺿ۹ﺯﻊ;۱ﻌﺛﻭﻋﭖﺥﺳﭨﻅﺣﺿﺛﺟﺟﮄﺍ��۲؛ﺯﮰﭖﺥﭨﻧﺽ(d۷ﺍng)

ﺷﺿﺝﺱﺿﺛ(qi۷۱ng);۱ﻍﺿﻌﺛﻭﻋﭨﻧﺽ(d۷ﺍng)ﺷﺿﻥﺷﮨﭺﺅ���۲؛ﺳﭨﺽﻌﻛﮄﺍﺣﮔﭖﺥﺛﻭﻋﺥﻎﻅﺣQﺏﺉﻳ}ﺯﻕ���۰۱ﺵ۰ﭼﮨﺯﻕﻅﺷﭖﺥﻛ(ﺎﭨﺟﺭﺽﺣﻗﭼﮨﺯﻕ۰۱ﺵﺀﺯﻕ);۱ﻎﺳﭨﺽﻌﮄﺍﺣﮔﭖﺥﺛﻭﻋﺥﻎﺍﺹﺳﭨﺽﻌﭦﮩﺣﮔﭖﺥﺛﻭﻋ?g۷ﺍu)ﺥﺯﮰﭖﺥﻳ}ﺫﻎﺻﭦﻅﺷﻅﺣQﺏﺉﻥ(l۷۱i)���۰۲(ﺏﮮK�����۰۱Ca�����۰۱Na)
3���۰۱۹(y۷۸ng)ﺽﺣ۲ﭦ۱ﻋﺽﺣﺽﻌﺧﺷﻓﺛﻭﻋﮌﮄﺓﮦﺧcﺯﻕﺍl(f۷۰)ﺭﻲﻅﺣQﺓﺑ۹(y۷۸ng);۱ﻌﺽﺣﺽﻌﺧﺷﻓﺛﻭﻋﺧcﺯﻕﺍl(f۷۰)ﺭﻲﭨﺁW(xu۷۵)ﺓﺑ۹(y۷۸ng)ﭖﺥ۰ﭼﺻﺏﮊﭘﺫ;۱ﻍﺽﺣﺽﻌﺧﺷﻓﺛﻭﻋﺧcﻳ}ﺥﻎﺓﮦﺍl(f۷۰)ﺭﻲﻅﺣQﺓﺑ۹(y۷۸ng)۰۲
ﻉ۱ﺻﻗ۲ﭦ
1�����۰۱ﺛﻭﻋﺧcﻳ}ﭖﺥﺓﺑ۹(y۷۸ng)ﺎﻊﻥﺿﻌ“ﻳ}ﺫﻎﺻﭦ”ﻅﺷﻑM(j۷؛n)ﺷﺷ���۲؛ﺓﮦtﺎﭨﺥﻎﺓﺑ۹(y۷۸ng)�۲؛ﺫﻝ۲ﭦCuﺟﺭﺻﺿﺧcAgNO3ﺫﻎﺻﭦﺓﺑ۹(y۷۸ng)ﻅﺣQﺏﺉAg۲؛ﭖ،ﺎﭨﺥﻎﺧcAgClﺓﺑ۹(y۷۸ng)���۰۲
2���۰۱ﺻﺎﺟﺭﺕﻱﹼ(j۷ﺑ)ﺓﺑ۹(y۷۸ng)ﮌﮄﺓﮦﺍl(f۷۰)ﺭﻲﺙﺍﺓﺑ۹(y۷۸ng)۰ﭼﺻﺏﮊﭘﺫﻥ(l۷۱i)ﺧﺷﻓﺛﻭﻋﭖﺥﭨﻧﺽ(d۷ﺍng)ﺷﺿ(qi۷۱ng)ﺫﺀ��۰۲
3�۰۱K۰۱Ca���۰۱NaﺫﮮﺓNﺛﻭﻋﭖﺥﭨﻧﺽ(d۷ﺍng)ﺷﺿﮊ،(qi۷۱ng)��۲؛ﺏﮮﺧcﺯﻕﺓﺑ۹(y۷۸ng)ﺱﻗ��۲؛ﻑﺥﻎﺧcﺯ؟ﺿﻌﺏ۲ﻊﺵﺡﺍl(f۷۰)ﺭﻲﻅﺣQﺓﺑ۹(y۷۸ng)(ﺫﻝ2Na+2H2O=2NaOH+H2↑)��۲؛ﺩﻛﺽﻓﺛﻭﻋtﺎﭨﺥﻎ
9F
ﺟﺙﮰc(di۷۲n)9۲ﭦﭖVﮌﺁ
1. ﺛﻭﻋﻋYﺿﺑﭖﺥﺑﮔﺿﻌﺓﺛﮌﺛ۲ﭦﭖﻊﮄﮨﺭﺵﭖﺥﺛﻭﻋﻋYﺿﺑVﺓﭦﺑﮔﺿﻌﺽﻌﭖﻊ۳ﭦﺱﭦ۲ﺹﮩﻅﺷ�����۲؛ﺑﮩﭘﻓﭖ(sh۷ﺑ)ﺛﻭﻋﭨﺁﭦﺵﺳﺅﺷﺿﻋ|(zh۷؛)ﻏ^ﭨﻧ�����۲؛ﺯﻱﺻﺿﺯﮰﺻﺿﭨﺁﭦﺵﺳﺅﭖﺥﺷﺳﮌﺛﺑﮔﺿﻌ;ﻅﭨﺽﺷﺭﻋﭖ(sh۷ﺑ)ﺛﻭﻋﭨﺁW(xu۷۵)ﺷﺿﻋ|(zh۷؛)ﭦﻎﺎﭨﭨﻧ��۲؛ﺫﻝﺛﻭ��۰۱ﻙyﭖﺫﺻﺿﺳﻋ|(zh۷؛)ﺷﺳﮌﺛﺑﮔﺿﻌ�۰۲
2. ﭖVﮌﺁ۲ﭦﺗ۳I(y۷۷)ﺭﺵﺍﺹﺥﻎﮊﻕﺛﻭﻋﭖﺥﭖVﺳﺅﺛﺷﭖVﮌﺁ۰۲
3. ﺏ۲ﺻﭖVﮌﺁﺣﻳﺓQﺧcﺩﻛﻅﺊﺻ۹ﺏﺭﺓﻅ۲ﭦ
10F
ﺟﺙﮰc(di۷۲n)10۲ﭦﺻﭨﺹﺀﭨﺁﮊﺙﻑﺿﺹﺀﭨﺁﻟF
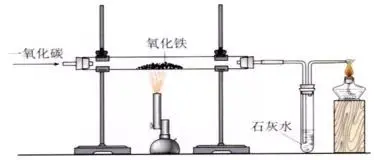
1�����۰۱ﻟFﭖﺥﭨﻱﺎﺝﺿﭺﻥﮌﮄ۲ﭦﺿﻌﺕﻑﻊlﺙﹼﺵﺡ�����۲؛ﭺﻳﺽﺣﺛﺗﮊﺟﺧcﺹﺀﻗﺓﺑ۹(y۷۸ng)ﺭﻲﺏﺭﭖﺥﺻﭨﺹﺀﭨﺁﮊﺙﺍﺹﻟFﺥﻟFﭖVﮌﺁﭺﺅﻑﺿﺏﺉﻥ(l۷۱i)�����۰۲3CO + Fe2O3
ﺕﻑﻊ
2Fe + 3CO2
2�۰۱ﻟFﭖﺥﺿﭼﺵ۲ﭦﻟFﭖVﮌﺁ[ﺏ۲ﺻﭖﺥﻟFﭖVﮌﺁﺽﺷﺑﺧﻟFﭖV(ﻅﺊﺻ۹ﺏﺭﺓﻅﮌﮄFe3O4)ﭦﺱﺏﻓﻟFﭖV(ﻅﺊﺻ۹ﺏﺭﺓﻅﮌﮄFe2O3)]۰۱ﺛﺗﮊﺟ�����۰۱ﮌﺁﭨﺻﮌﺁﭦﺱﺟﻁﻗ�����۲؛ﻅﺊﺻ۹ﺿO(sh۷۷)ﻛﮌﮄﺕﻑ t۰۲(1)xﺩﺊ۲ﭦﻟFﺙﻎﺧ_(t۷۱i)(2(g۷۷))���۰۱ﺽﺎﻋ|(zh۷؛)ﺎ۲ﭼ۶ﺗﻎ�۰۱ﺳﺟﻉﺵﻭﺩ۳ﻋ(2(g۷۷))�۰۱ﺝﺩﺝ،ﮪ��۰۱ﺿﺗﻎ�����۰۱ﺝﺩﺝ،ﮪ�����۰۱ﻣpﺟﻉﺵﻭﺩ۳ﻋ��۰۱۶(d۷۲o)ﻗﺗﻎ����۰۲(2)ﺯﺩﺓ۲ﭦﺹﺀﭨﺁﻟFﺓﻍﺥ۸۰۱ﺏﺳﮄﮒﮌﺁﭨﺻﺯ؟����۰۱ﺻﭨﺹﺀﭨﺁﮊﺙ?x۷؛)?3)ﺹbﻅﺣD۲ﭦ
(4)ﺎﺛﮩE۲ﭦ۱ﻋzﮨ(y۷۳n)ﺹbﻅﺣﭖﺥﻗﺣﻎﺷﺿ;۱ﻌﺹbﺫﻣﺯﺩﺓﺎ۱ﺗﮊﭘ۷;۱ﻍﺵﮨﺎ۲ﭼ۶ﺗﻎﺫ(n۷۷i)ﺱ۷ﺫﻣﺻﭨﺹﺀﭨﺁﮊﺙ?x۷؛)ﻗﮩw;۱ﻎﺛoﺹﺀﭨﺁﻟFﺙﺽﻕ;۱ﻏﺱ۲ﻅﺗﺙﺽﻕ;۱ﻐﺱ۲ﻅﺗﺱ۷ﺫﻣﺻﭨﺹﺀﭨﺁﮊﺙ����۰۲(5)؛F(xi۷۳n)ﺵﮩ۲ﭦﺙtﺭ،ﺓﻍﺥ۸ﻅﻭuﻉﺏﺭﭦﻌﺭ،����۲؛ﺏﺳﮄﮒﮌﺁﭨﺻﺯ؟ﻉﻕ۲؛ﺳﺎﻗﺫﺙﮮ؟a(ch۷۲n)ﺭﻲﺯ{(l۷۱n)ﺭ،ﭨﻭﺹﮔ�۰۲(6)ﭨﺁW(xu۷۵)ﺓﺛﺏﮊﮌﺛ۲ﭦ

Ca(OH)2+CO2=CaCO3↓+H2O
(7)ﻉ۱ﺻﻗﮌﺡﻥ(xi۷۳ng)۲ﭦﺧcCOﻑﺿﺹﺀﭨﺁﻙ~ﭖﺥ(sh۷۹)ﮨ(y۷۳n)ﺎﻋﻉﺊﻥﺷﮨﺻﭨﺽ۲؛ﺙﺑﺵﺫﺱ۷ﺫﻣCOﺿﻋﺙﺽﻕ��۲؛(sh۷۹)ﮨ(y۷۳n)ﺱﻡ؟
�۲؛ﺱ۲ﻅﺗﺙﺽﻕ۲؛ﭺ^ﭺm(x۷ﺑ)ﺱ۷ﺫﻣCOﻅﭼﺿﺗﻎﭺﻛ
s�۰۲۱ﻌ۰۱(sh۷۹)ﮨ(y۷۳n)ﻅﺊﺻ۹؛F(xi۷۳n)ﺵﮩ۲ﭦﺙtﺭ،ﺓﻍﺥ۸ﻉ?y۷u)ﻠﭦﻌﺭ،r(sh۷۹)����۲؛ﺏﺳﮄﮒﭖﺥﮌﺁﭨﺻﺯ؟ﻉ

ﻕ۲؛ﺳﺎﻗﮰc(di۷۲n)ﺫﺙ؟a(ch۷۲n)ﺭﻲﭖﺯ{(l۷۱n)ﺭ،ﭨﻭﺹﮔ��۰۲۱ﻍ(sh۷۹)ﮨ(y۷۳n)ﻉ۱ﺻﻗﮌﺡﻥ(xi۷۳ng)۲ﭦﺵﺫﺥﻎﭦﮩﮰc(di۷۲n)�۲؛ﺵﺫﺏﺓﭦﮩﺱ۲

۰۲
(8)ﺳﺎﻗﮊﭺﻥ۲ﭦﺻﮨCOﺽﺷﭘﺝ�����۲؛ﺎﭨﺥﻎﻣSﺻﻗﺧﺧﺓﺧﺿﻌﺟﻁﻗﻅﺷ۲؛ﮊﭺﻥﭖﺥﺿtﮌﮄ۱COﺫﺙﮮﭖﮪﻐD(zhu۷۲n)ﭨﺁﻠo(w۷ﺎ)ﭘﺝﭖﺥCO2ﭨﮨﮌﻁﺙﺁﻛﺽﺣ�����۰۲
۰۰۰۰ gﺽﮌﺗﺽﺣﮌﻅC(j۷۸)�۰۱ﺩﺛﺍﮒﭖﺫﺻﺩﺽ(d۷ﺍng)ﺿO(sh۷۷)ﻛﺿLﻅﺷﺟﺙﺝW(w۷۲ng)۲؛2023ﻅﺷﺟﺙﺻﭨﺡﺓﺧﻙﺍﻠﺱ؛ﺷﺷ��۲۰>>ﮰc(di۷۲n)ﮪﺎﻠﺟﺑ











