вcј°Жд»ҜәПОп
Т»ЎўвcөДОпАнРФЩ|(zhЁ¬)
1.оҒЙ«Јәгy°ЧЙ«�����ЎўУРҪрҢЩ№вқЙ�����ЎЈ
2.ГЬ¶ИЈәвcЎўЛ®әНГәУНөДГЬ¶ИҙуРЎһйρ(Л®)>ρ(вc)>ρ(ГәУН)�����ЎЈ
3.ИЫьc(diЁЈn)ЈәРЎУЪ(Мо“ҙуУЪ”“РЎУЪ”»т“өИУЪ”)100 ЎжЎЈ
4.УІ¶ИЈәЩ|(zhЁ¬)өШЭ^Ьӣ�����ЎЈ
¶ю�����ЎўҸДФӯЧУҪY(jiЁҰ)ҳӢ(gЁ°u)ХJ(rЁЁn)ЧRвcөД»ҜҢW(xuЁҰ)РФЩ|(zhЁ¬)——ЯҖФӯРФ

1.вcЕc·ЗҪрҢЩҶОЩ|(zhЁ¬)·ҙ‘Ә(yЁ©ng)
(1)ЕcO2·ҙ‘Ә(yЁ©ng)
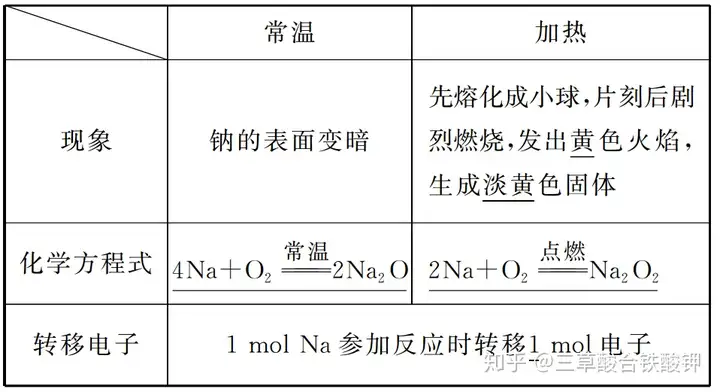
(2)ЕcCl2·ҙ‘Ә(yЁ©ng)өД»ҜҢW(xuЁҰ)·ҪіМКҪЈә2Na+Cl2ьc(diЁЈn)Иј(=====)2NaClЎЈ
(3)ЕcS·ҙ‘Ә(yЁ©ng)өД»ҜҢW(xuЁҰ)·ҪіМКҪЈә2Na+SЎч(=====)Na2S�����ЎЈ
2.вcЕcЛ®Ўўы}ИЬТәөД·ҙ‘Ә(yЁ©ng)
(1)вcЕcЛ®өД·ҙ‘Ә(yЁ©ng)
ўЩвcЕcЛ®·ҙ‘Ә(yЁ©ng)өДлxЧУ·ҪіМКҪЈә2Na+2H2O===2Na++2OH-+H2↑�����ЎЈ
ўЪвcЕcЛ®(ә¬·УМӘ)·ҙ‘Ә(yЁ©ng)өДҢҚтһ¬F(xiЁӨn)Пуј°ҪвбҢЈә

(2)вcЕcы}ИЬТәөД·ҙ‘Ә(yЁ©ng)
NaПИәНЛ®·ҙ‘Ә(yЁ©ng)ЙъіЙNaOHФЩЕcы}ИЬТә·ҙ‘Ә(yЁ©ng)Ј¬ІўЕР”аКЗ·с°l(fЁЎ)ЙъҸН(fЁҙ)·ЦҪв·ҙ‘Ә(yЁ©ng)
ИзвcН¶ИлCuSO4ИЬТәЦР�����Ј¬·ҙ‘Ә(yЁ©ng)өДлxЧУ·ҪіМКҪһй2Na+2H2O+Cu2+===2Na++Cu(OH)2↓+H2↑ЎЈ
вcН¶ИлBaCl2ИЬТәЦР�����Ј¬·ҙ‘Ә(yЁ©ng)өД»ҜҢW(xuЁҰ)·ҪіМКҪһй2Na+2H2O===2NaOH+H2↑�����ЎЈ
3.вcЕcы}ЛбөД·ҙ‘Ә(yЁ©ng)
вcЕcы}Лб·ҙ‘Ә(yЁ©ng)өДлxЧУ·ҪіМКҪһй2Na+2H+===2Na++H2↑
ИэЎўвcөДЦЖИЎ�����ЎўұЈҙжј°УГНҫ
1.ЦЖИЎЈә»ҜҢW(xuЁҰ)·ҪіМКҪһй2NaCl(ИЫИЪ)НЁлҠ(=====)2Na+Cl2↑�����ЎЈ
2.ұЈҙжЈәГЬ·вұЈҙж�����Ј¬НЁіЈұЈҙжФЪКҜПһУН»тГәУНЦРЎЈ
3.УГНҫ
(1)вc�����ЎўвӣәПҪр(Тә‘B(tЁӨi))ҝЙУГУЪФӯЧУ·ҙ‘Ә(yЁ©ng)¶СөДҢ§(dЁЈo)ҹб„©�����ЎЈ
(2)ЧчҸҠ(qiЁўng)ЯҖФӯ„©Ј¬ҢўДіР©ПЎУРҪрҢЩҸДЛьӮғөДыu»ҜОпЦРЯҖФӯіцҒн�����Ј¬Из4Na+TiCl4ИЫИЪ(=====)Ti+4NaClЎЈ
(3)УГЧчлҠ№вФҙ�����Ј¬ЦЖЧчёЯүәвcҹфЎЈ
ЛД�����ЎўСх»ҜвcЕcЯ^Сх»ҜвcөДұИЭ^
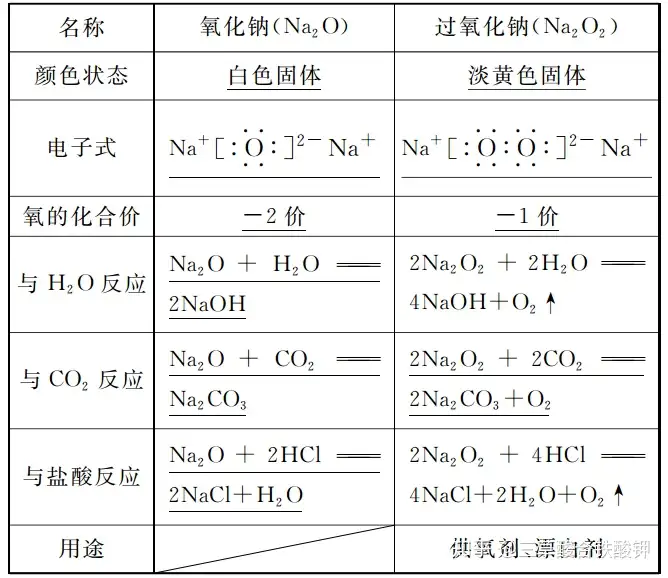
ҝӮҪY(jiЁҰ)
1.вcөДИЎУГ·Ҫ·ЁЈәУГиҮЧУҠAИЎТ»РЎүKвc�����Ј¬УГһVјҲОьёЙұнГжөДГәУН�����Ј¬УГРЎө¶ЗРИЎьS¶№ҙуРЎөДвc�����Ј¬КЈУаөДвc·Е»ШФҮ„©ЖҝЎЈ
2.вcК§»рөДМҺАнЈәЙіНБЙwңз�����Ј¬І»ДЬУГЛ®»тЕЭДӯңз»рЖчңз»р�����ЎЈ
3.Na2O2ЦРСхФӘЛШөД»ҜәПғrһй-1ғr¶шІ»КЗ-2ғr�����ЎЈ
4.Na2O2ҫ§уwЦРкҺ�����Ўўк–лxЧУӮҖ”ө(shЁҙ)ұИһй1ЎГ2¶шІ»КЗ1ЎГ1�����ЎЈ
5.Я^Сх»ҜвcЕcЯҖФӯРФИЬТә·ҙ‘Ә(yЁ©ng)өД»ҜҢW(xuЁҰ)·ҪіМКҪөД•шҢ‘ІҪуEЈә
өЪТ»ІҪЈәNa2O2ЕcИЬТәЦРөДЛ®·ҙ‘Ә(yЁ©ng)ЙъіЙNaOHәНO2;
өЪ¶юІҪЈә·ҙ‘Ә(yЁ©ng)ЙъіЙөДO2ЕcЯҖФӯРФы}°l(fЁЎ)ЙъСх»ҜЯҖФӯ·ҙ‘Ә(yЁ©ng);
өЪИэІҪЈәҢўЙПКцғЙӮҖ·ҙ‘Ә(yЁ©ng)өД»ҜҢW(xuЁҰ)·ҪіМКҪәПІўЈ¬јҙөГҝӮөД»ҜҢW(xuЁҰ)·ҪіМКҪ�����ЎЈ
6.Na2O2ЕcH2OЎўCO2·ҙ‘Ә(yЁ©ng)өДғЙӮҖіЈТҠХ`…^(qЁұ)
(1)Na2O2ЕcH2O�����ЎўCO2·ҙ‘Ә(yЁ©ng)¶јКЗЧФЙнөДСх»ҜЯҖФӯ·ҙ‘Ә(yЁ©ng);
(2)1 mol Na2O2ЕcЧгБҝCO2»тH2O°l(fЁЎ)Йъ·ҙ‘Ә(yЁ©ng)•r�����Ј¬ЮD(zhuЁЈn)ТЖөДлҠЧУ”ө(shЁҙ)КЗNA¶шІ»КЗ2NAЎЈ
1.ҪрҢЩвcЕcы}»түAИЬТә·ҙ‘Ә(yЁ©ng)өДЛјҫSДЈ°е

2.ҪрҢЩвcЕcИЬТә·ҙ‘Ә(yЁ©ng)¬F(xiЁӨn)Пу·ЦОцЛјҫSДЈ°е
(1)№ІРФЈәТтһйвcЕcІ»Н¬өДЛ®ИЬТә·ҙ‘Ә(yЁ©ng)ҫщҢЩУЪ„ЎБТөДЦГ“Q·ҙ‘Ә(yЁ©ng)�����Ј¬№КУР№ІН¬өД¬F(xiЁӨn)Пу®a(chЁЈn)ЙъЈәўЩё�����ЎЈәвcёЎФЪТәГжЙП;ўЪИЫЈәвcИЫ»ҜіЙ№вББөДРЎЗт;ўЫУОЈәФЪТәГжЙПІ»НЈөШУО„УЦұЦБ·ҙ‘Ә(yЁ©ng)Нк;ўЬн‘Јә·ҙ‘Ә(yЁ©ng)ЦРІ»НЈөШ°l(fЁЎ)іц“Л»Л»”өДн‘В•�����ЎЈ
(2)Іо®җРФЈәЕcЛбЎўҸҠ(qiЁўng)ЛбИхүAы}ИЬТә·ҙ‘Ә(yЁ©ng)•r�����Ј¬УЙУЪИЬТәЦРH+қв¶ИЭ^ҙу�����Ј¬·ҙ‘Ә(yЁ©ng)ұИЕcЛ®ЯҖТӘ„ЎБТЈ¬ЧоәувcҝЙДЬФЪТәГжЙПИјҹэ;Еcы}ИЬТә·ҙ‘Ә(yЁ©ng)•r�����Ј¬ЯҖҝЙДЬ•юЙъіЙіБөн(ИзЙъіЙлyИЬүA)�����Ўўҡвуw(NH3)өИЎЈ
1.вcЕcСхҡв·ҙ‘Ә(yЁ©ng)өД®a(chЁЈn)ОпЕc·ҙ‘Ә(yЁ©ng)ңШ¶ИУРкP(guЁЎn)�����Ј¬јУҹб»тьc(diЁЈn)Иј®a(chЁЈn)ОпКЗЯ^Сх»ҜвcЎЈ
2.І»№ЬЙъіЙСх»ҜвcЯҖКЗЯ^Сх»Ҝвc�����Ј¬ҪрҢЩвcК§лҠЧУҫщЧғ?yЁӯu)?1ғrөДк–лxЧУ�����Ј¬Тт¶шөИБҝөДвcНкИ«·ҙ‘Ә(yЁ©ng)К§ИҘөДлҠЧУ”ө(shЁҙ)ПаН¬
1.УРкP(guЁЎn)Na2O2ЕcCO2ЎўH2OөД·ҙ‘Ә(yЁ©ng)өДҺЧӮҖЦШТӘкP(guЁЎn)Пө
2CO2+2Na2O2===2Na2CO3+O2
2H2O+2Na2O2===4NaOH+O2↑
(1)ОпЩ|(zhЁ¬)өДБҝөДкP(guЁЎn)Пө
ҹoХ“КЗCO2»тH2OөДҶОТ»ОпЩ|(zhЁ¬)ЯҖКЗ¶юХЯөД»мәПОп�����Ј¬НЁЯ^ЧгБҝөДNa2O2•rЈ¬CO2»тH2OЕc·ЕіцO2өДОпЩ|(zhЁ¬)өДБҝЦ®ұИҫщһй2ЎГ1�����ЎЈ
(2)ҡвуwуw·eкP(guЁЎn)Пө
ИфCO2әНЛ®ХфҡвөД»мәПҡвуw(»тҶОТ»ҡвуw)НЁЯ^ЧгБҝNa2O2�����Ј¬ҡвуwуw·eөДңpЙЩБҝөИУЪФӯ»мәПҡвуwуw·eөД2(1)ЗТөИУЪЙъіЙСхҡвөДуw·e�����ЎЈ
(3)лҠЧУЮD(zhuЁЈn)ТЖкP(guЁЎn)Пө
®”(dЁЎng)Na2O2ЕcCO2�����ЎўH2O·ҙ‘Ә(yЁ©ng)•rЈ¬ОпЩ|(zhЁ¬)өДБҝкP(guЁЎn)Пөһй2Na2O2Ў«O2Ў«2e-�����ЎЈ
(4)№МуwЩ|(zhЁ¬)БҝкP(guЁЎn)Пө
Па®”(dЁЎng)УЪ№Муw(Na2O2)Ц»ОьКХБЛCO2ЦРөД“CO”Ј¬H2OЦРөД“H2”;ҝЙТФҝҙЧч°l(fЁЎ)ЙъПа‘Ә(yЁ©ng)өД·ҙ‘Ә(yЁ©ng)ЈәNa2O2+CO===Na2CO3�����ЎўNa2O2+H2===2NaOH(ҢҚлHЙПғЙ·ҙ‘Ә(yЁ©ng)І»ДЬ°l(fЁЎ)Йъ)ЎЈ
(5)ПИәунҳРткP(guЁЎn)Пө
Т»¶ЁБҝөДNa2O2ЕcТ»¶ЁБҝөДCO2әНH2O(g)өД»мәПОпөД·ҙ‘Ә(yЁ©ng)�����Ј¬ҝЙТ•ЧчNa2O2ПИЕcCO2·ҙ‘Ә(yЁ©ng)Ј¬ҙэCO2·ҙ‘Ә(yЁ©ng)НкіЙәу�����Ј¬Na2O2ФЩЕcH2O(g)°l(fЁЎ)Йъ·ҙ‘Ә(yЁ©ng)�����ЎЈ
2.ФцЦШБҝөИУЪҝЙИјОпЩ|(zhЁ¬)БҝөДТҺ(guЁ©)ВЙ
·І·ЦЧУҪMіЙ·ыәП(CO)m·(H2)nөДОпЩ|(zhЁ¬)�����Ј¬WgФ“ОпЩ|(zhЁ¬)ФЪO2ЦРНкИ«Ијҹэ�����Ј¬ҢўЖд®a(chЁЈn)Оп(CO2әНЛ®Хфҡв)НЁЯ^ЧгБҝөДNa2O2ә󣬹МуwФцЦШұШһйWgЎ�����Ј»тКЗУЙC�����ЎўH�����ЎўOИэ·NФӘЛШҪMіЙөДОпЩ|(zhЁ¬)Ј¬Ц»ТӘC�����ЎўOФӯЧУӮҖ”ө(shЁҙ)ұИһй1ЎГ1Ј¬јҙҝЙқMЧгФ“—lјю�����ЎЈ
ЦРҢW(xuЁҰ)лA¶ОіЈТҠөД·ыәПЯ@Т»кP(guЁЎn)ПөөДОпЩ|(zhЁ¬)УРЈә
(1)ҹoҷC(jЁ©)ОпЈәH2ЎўCOј°H2әНCOөД»мәПҡвуw�����ЎЈ
(2)УРҷC(jЁ©)ОпЈәCH3OH(јЧҙј)ЎўHCHO(јЧИ©)�����ЎўCH3COOH(ТТЛб)�����ЎўHCOOCH3(јЧЛбјЧхҘ)�����ЎўC6H12O6(ЖПМСМЗ)өИ�����ЎЈ
Я^Сх»ҜвcөДҸҠ(qiЁўng)Сх»ҜРФ
1.Na2O2ЕcSO2·ҙ‘Ә(yЁ©ng)ЈәNa2O2+SO2===Na2SO4ЎЈ
2.Na2O2Н¶ИлFeCl2ИЬТәЦР�����Ј¬ҝЙҢўFe2+Сх»ҜіЙFe3+�����Ј¬Н¬•rЙъіЙFe(OH)3іБөн�����ЎЈ
3.Na2O2Н¶ИлҡдБтЛбЦРЈ¬ҝЙҢўH2SСх»ҜіЙҶОЩ|(zhЁ¬)Бт�����Ј¬ИЬТәЧғңҶқбЎЈ
4.Na2O2Н¶ИлNa2SO3ИЬТәЦР�����Ј¬ҝЙҢўSO3(2-)Сх»ҜіЙSO4(2-)ЎЈ
5.Na2O2ҫЯУРЖҜ°ЧРФ�����Ј¬Н¶ИлЖ·јtИЬТәЦР�����Ј¬ҝЙК№Ж·јtИЬТәНКЙ«
вcөДЦШТӘ»ҜәПОп
1.МјЛбвcәНМјЛбҡдвc

2.вcј°ЖдЦШТӘ»ҜәПОпйgөДЮD(zhuЁЈn)»ҜкP(guЁЎn)Пө

ҲDЦРҺ§ҳЛ(biЁЎo)М–өДУРкP(guЁЎn)·ҙ‘Ә(yЁ©ng)өД»ҜҢW(xuЁҰ)·ҪіМКҪЈә
ўЩ2Na+O2ьc(diЁЈn)ИјNa2O2;
ўЪ2Na+2H2O===2NaOH+H2↑;
ўЫ2Na2O2+2H2O===4NaOH+O2↑;
ўЬ2Na2O2+2CO2===2Na2CO3+O2;
ўЭ2NaOH+CO2===Na2CO3+H2O;
ўЮ2NaCl+2H2OлҠҪв2NaOH+Cl2↑+H2↑�����ЎЈ
3.Na2CO3өДЦЖӮдј°УГНҫ
(1)Na2CO3өД№ӨҳI(yЁЁ)ЦЖӮд——әоКПЦЖүA·Ё
ўЩЦЖӮдФӯАн
°С¶юСх»ҜМјНЁИл°ұөДВИ»Ҝвcп–әНИЬТәЦРЈ¬К№ИЬҪв¶ИЭ^РЎөДМјЛбҡдвcҸДИЬТәЦРОціц�����Ј¬Я^һVөГөҪМјЛбҡдвcҫ§уwЈ¬МјЛбҡдвcКЬҹб·ЦҪвЙъіЙМјЛбвc�����ЎЈ
ўЪ·ҙ‘Ә(yЁ©ng)өД»ҜҢW(xuЁҰ)·ҪіМКҪ
a.NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl;
b.2NaHCO3Ўч(=====)Na2CO3+CO2↑+H2OЎЈ
(2)Na2CO3�����ЎўNaHCO3өДУГНҫ
ўЩNa2CO3КЗТ»·N·ЗіЈЦШТӘөД»Ҝ№ӨФӯБПЈ¬ФЪІЈБ§�����Ўў·КФнЎўәПіЙПҙңм„©�����ЎўФмјҲЎўјҸҝ—�����ЎўКҜУНЎўТұҪр�����ЎўКіЖ·өИ№ӨҳI(yЁЁ)ЦРУРЦшҸV·әөД‘Ә(yЁ©ng)УГ�����ЎЈ
ўЪNaHCO3КЗұәЦЖёвьc(diЁЈn)ЛщУГөД°l(fЁЎ)ҪН·ЫөДЦчТӘіЙ·ЦЦ®Т»;ФЪбt(yЁ©)ҜҹЙП�����Ј¬ЛьКЗЦОҜҹОёЛбЯ^¶аөДТ»·NЛҺ„©�����ЎЈ
4.Na2CO3әНNaHCO3өДұИЭ^
(1)Na2CO3�����ЎўNaHCO3өДиb„e
ўЩИфһй№Муw
ҝЙАыУГјУҹб·Ё�����ЎЈјУҹб®a(chЁЈn)ЙъК№іОЗеКҜ»ТЛ®ЧғңҶқбөДҡвуwөДКЗNaHCO3ЎЈ
ўЪИфһйИЬТә
ҝЙАыУГіБөн·Ё�����ЎЈјУИлBaCl2ИЬТә�����Ј¬®a(chЁЈn)Йъ°ЧЙ«іБөнөДКЗNa2CO3;ТІҝЙАыУГҡвуw·Ё�����ЎЈөОјУПЎы}ЛбЈ¬Бўјҙ®a(chЁЈn)ЙъҡвЕЭөДКЗNaHCO3�����Ј¬й_КјҹoҡвЕЭ®a(chЁЈn)ЙъөДКЗNa2CO3�����ЎЈ
(2)Na2CO3�����ЎўNaHCO3әНы}ЛбөД·ҙ‘Ә(yЁ©ng)
Na2CO3ИЬТәәНПЎы}Лб·ҙ‘Ә(yЁ©ng)ҝЙАнҪвһй·ЦІҪ·ҙ‘Ә(yЁ©ng)Јә
Na2CO3+HCl===NaHCO3+NaCl
NaHCO3+HCl===NaCl+H2O+CO2↑
NaHCO3ИЬТәәНПЎы}Лб·ҙ‘Ә(yЁ©ng)өД»ҜҢW(xuЁҰ)·ҪіМКҪһй
NaHCO3+HCl===NaCl+CO2↑+H2O
ўЩ·ЕіцCO2өДЛЩВК
NaHCO3ИЬТәЕcы}Лб·ҙ‘Ә(yЁ©ng)·ЕіцCO2өДЛЩВКҝмЎЈ
ўЪNa2CO3ИЬТәЕcы}ЛбөД»ҘөОиb„e
ПтNa2CO3ИЬТәЦРЦрөОјУИлы}Лб�����Ј¬й_КјҹoҡвЕЭ®a(chЁЈn)ЙъЈ¬¶шПты}ЛбЦРөОјУNa2CO3ИЬТә�����Ј¬й_КјҫНУРҡвЕЭ®a(chЁЈn)ЙъЎЈ
ўЫCO2ЙъіЙБҝұИЭ^
a.өИОпЩ|(zhЁ¬)өДБҝөДNa2CO3�����ЎўNaHCO3·Ц„eЕcЧгБҝөДы}Лб·ҙ‘Ә(yЁ©ng)�����Ј¬®a(chЁЈn)ЙъөДCO2ПаөИ�����ЎЈ
b.өИЩ|(zhЁ¬)БҝөДNa2CO3ЎўNaHCO3·Ц„eЕcЧгБҝөДы}Лб·ҙ‘Ә(yЁ©ng)�����Ј¬NaHCO3®a(chЁЈn)ЙъөДCO2¶а�����ЎЈ
c.өИБҝөДы}ЛбЕcЧгБҝөДNa2CO3�����ЎўNaHCO3·Ц„e·ҙ‘Ә(yЁ©ng)�����Ј¬NaHCO3®a(chЁЈn)ЙъөДCO2¶а�����ЎЈ
d.Т»¶ЁБҝөДNaHCO3КЬҹб·ЦҪв®a(chЁЈn)ЙъөДCO2БҝЕcКЬҹб·ЦҪвәуөДҡҲБфОпЕcы}Лб·ҙ‘Ә(yЁ©ng)®a(chЁЈn)ЙъөДCO2БҝПаөИЎЈ
5.”ө(shЁҙ)РОҪY(jiЁҰ)әПЛјПлАнҪвNa2CO3�����ЎўNaHCO3Еcы}ЛбөД·ҙ‘Ә(yЁ©ng)
(1)ы}ЛбЦрөОјУИлNa2CO3ИЬТәЦР(ы}ЛбІ»Чг•r)
ўЩ¬F(xiЁӨn)ПуЈәй_КјҹoГчп@¬F(xiЁӨn)ПуЈ¬әуУРҹoЙ«ҡвуw·Еіц�����ЎЈ
ўЪ·ҙ‘Ә(yЁ©ng)ЈәҹoГчп@¬F(xiЁӨn)Пу•r·ҙ‘Ә(yЁ©ng)өДлxЧУ·ҪіМКҪЈәCO3(2-)+H+===HCO3(-)�����Ј¬УРҹoЙ«ҡвуw·Еіц•r·ҙ‘Ә(yЁ©ng)өДлxЧУ·ҪіМКҪЈәHCO3(-)+H+===CO2↑+H2O�����ЎЈ
(2)Na2CO3ИЬТәЦрөОјУИлПЎы}ЛбЦР(ы}ЛбЯ^Бҝ•r)
ўЩ¬F(xiЁӨn)ПуЈәУРҹoЙ«ҡвуw·ЕіцЎЈиb„eNa2CO3�����ЎўNaHCO3өДіЈУГ·Ҫ·Ё
ўЪ·ҙ‘Ә(yЁ©ng)өДлxЧУ·ҪіМКҪЈәCO3(2-)+2H+===CO2↑+H2OЎЈ
(3)МјЛбвc�����ЎўМјЛбҡдвcЕcы}Лб·ҙ‘Ә(yЁ©ng)өД»щұҫҲDПу
ўЩПтNa2CO3ЦРЦрөОјУИлы}Лб�����Ј¬ПыәДHClИЬТәөДуw·eЕc®a(chЁЈn)ЙъCO2өДуw·eөДкP(guЁЎn)ПөИзҲDјЧЛщКҫЎЈ
ўЪПтNaHCO3ЦРЦрөОјУИлы}Лб�����Ј¬ПыәДHClИЬТәөДуw·eЕc®a(chЁЈn)ЙъCO2өДуw·eөДкP(guЁЎn)ПөИзҲDТТЛщКҫ�����ЎЈ
ўЫПтNaOH�����ЎўNa2CO3өД»мәПОпЦРЦрөОјУИлы}Лб�����Ј¬ПыәДHClИЬТәөДуw·eЕc®a(chЁЈn)ЙъCO2өДуw·eөДкP(guЁЎn)ПөИзҲDұыЛщКҫ(ФO(shЁЁ)NaOH�����ЎўNa2CO3өДОпЩ|(zhЁ¬)өДБҝЦ®ұИһйxЎГy=1ЎГ1Ј¬ЖдЛыұИАэ•rөДҲDПуВФ)�����ЎЈ
ўЬПтNa2CO3�����ЎўNaHCO3өД»мәПОпЦРЦрөОјУИлы}Лб�����Ј¬ПыәДHClИЬТәөДуw·eЕc®a(chЁЈn)ЙъCO2өДуw·eөДкP(guЁЎn)ПөИзҲD¶ЎЛщКҫ(ФO(shЁЁ)Na2CO3�����ЎўNaHCO3өДОпЩ|(zhЁ¬)өДБҝЦ®ұИһйmЎГn=1ЎГ1�����Ј¬ЖдЛыұИАэ•rөДҲDПуВФ)ЎЈ
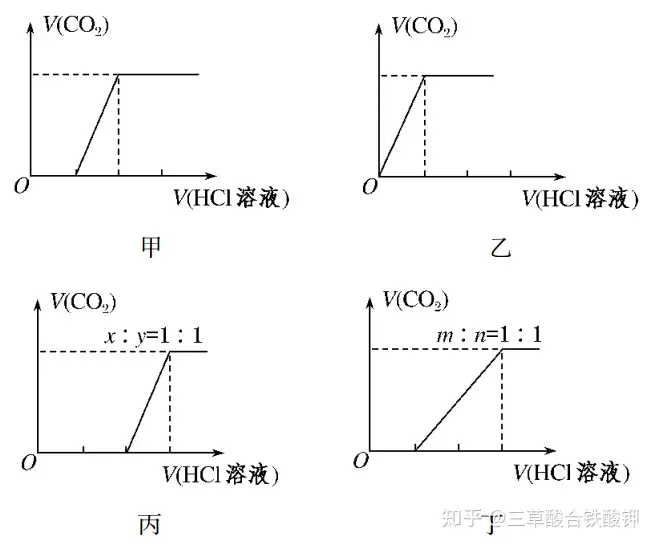
иb„eNa2CO3ЎўNaHCO3өДіЈУГ·Ҫ·Ё

ЎЎЎЎ ҡgУӯК№УГКЦҷC(jЁ©)�����ЎўЖҪ°еөИТЖ„УФO(shЁЁ)ӮдФLҶ–ЦРҝјҫW(wЁЈng)Ј¬2024ЦРҝјТ»В·Ег°йН¬РР�����ЈЎ>>ьc(diЁЈn)“фІйҝҙ


















