╥╗бв╦с╨╘╚▄╥║║═ЙA╨╘╚▄╥║
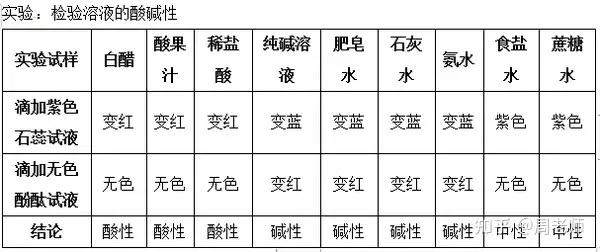
╜Y(jiиж)╒Уг║
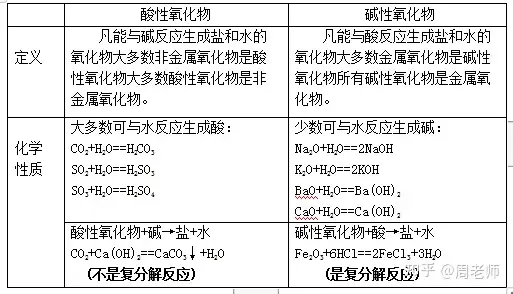
(1)╖▓╩╟─▄╩╣╫╧╔л╩п╚я╘З╥║╫Г╝t╡─╚▄╥║╢╝╩╟╦с╨╘╚▄╥║гм▓в╟╥╘У╚▄╥║▓╗─▄╩╣Яo╔л╖╙╠к╘З╥║╫Г╔л;
(2)╖▓╩╟─▄╩╣╫╧╔л╩п╚я╘З╥║╫Г╦{╡─╚▄╥║╢╝╩╟ЙA╨╘╚▄╥║����гм▓в╟╥╘У╚▄╥║─▄╩╣Яo╔л╖╙╠к╘З╥║╫Г╝t;
(3)▓╗─▄╩╣╫╧╔л╩п╚я╘З╥║╫Г╔лгм╥▓▓╗─▄╩╣Яo╔л╖╙╠к╘З╥║╫Г╔л╡─╚▄╥║����гм╬╥ВГ╖QЮщ╓╨╨╘╚▄╥║����бг
(4)╚ч╫╧╔л╩п╚я╘З╥║╝░Яo╔л╖╙╠к╡╚─▄ЩzҐЮ╚▄╥║╦сЙA╨╘╡─╘З╥║гм╖QЮщ╦сЙA╓╕╩╛Дй����бг
╫в╥тг║в┘╬╥ВГ╙╨Хr║Ґ▀А╙├╦{╔л╗Ґ╝t╔л╩п╚я╘З╝ИБэЩzҐЮ╚▄╥║╡─╦сЙA╨╘;
в┌╦с╨╘╚▄╥║─▄╩╣╦{╔л╩п╚я╘З╝И╫Г╝tгмЙA╨╘╚▄╥║─▄╩╣╝t╔л╩п╚я╘З╝И╫Г╦{;
в█╓╗╙╨┐╔╚▄╨╘╡─╦с╨╘����бвЙA╨╘╬я┘|(zhим)▓┼─▄╩╣╓╕╩╛Дй╫Г╔л����гм╫Г╔л╡─╩╟╓╕╩╛Дйгм╢Ї▓╗╩╟╘У╬я┘|(zhим)����бг
2.╚╒│г╔·╗ю╓╨│г╥К╡─╦с╨╘╬я┘|(zhим)┼cЙA╨╘╬я┘|(zhим)
(1)╦с╨╘╬я┘|(zhим)г║╔╜щл����бвЩО├╩����бв╕╠щ┘бв╬і╝t╩┴╡╚;
(2)ЙA╨╘╬я┘|(zhим)г║▓ш╚~ЙA����бвЯЯЙA╡╚бг
3.Е^(qи▒)╖╓╦с╚▄╥║║═╦с╨╘╚▄╥║����бвЙA╚▄╥║║═ЙA╨╘╚▄╥║
╫в╥тг║╦с╚▄╥║╩╟╓╕╦с╡─╦о╚▄╥║гм╦с╨╘╚▄╥║╩╟╓╕─▄╩╣╫╧╔л╩п╚я╘З╥║╫Г╝t╡─╚▄╥║����гм╥Ґ┤╦╦с╚▄╥║╥╗╢и╩╟╦с╨╘╚▄╥║гм╢Ї╦с╨╘╚▄╥║▓╗╥╗╢и╩╟╦с╚▄╥║;═мШ╙����гмЙA╨╘╚▄╥║▓╗╥╗╢и╩╟ЙA╚▄╥║гмЙA╚▄╥║╥╗╢и╩╟ЙA╨╘╚▄╥║бг
└¤╚чг║┴Ґ╦су~����бв┬╚╗пф@╡─╦о╚▄╥║я@╦с╨╘гм╢Ї▓╗╩╟╦с;╝ГЙA����бв╖╩╘э╡─╦о╚▄╥║я@ЙA╨╘гм╡л▓╗╩╟ЙA����бг
4.╤a│ф╓к╫Rг║╦сбвЙA����бв√}╡─╕┼─ю
(1)╦сг║ыКыxХr╔·│╔╡─ъЦыx╫╙╚л▓┐╩╟Ъфыx╫╙╡─╗п║╧╬ябг╚чг║HCl����бвHNO3бвH2SO4����бвH2CO3╡╚����бг
HCl==H++Cl-;H2SO4==2H++SO42-;
(2)ЙAг║ыКыxХr╔·│╔╡─ъОыx╫╙╚л▓┐╩╟Ъф╤є╕їыx╫╙╡─╗п║╧╬я����бг╚чг║NaOH����бвCa(OH)2╡╚бг
NaOH==Na++OH-;Ca(OH)2==Ca2++2OH-;
(3)√}г║ыКыxХr╔·│╔╜ЁМ┘ыx╫╙(╗Ґф@╕їыx╫╙)║═╦с╕їыx╫╙╡─╗п║╧╬я����бг╚чг║NaClбвNH4NO3╡╚����бг
NaCl==Na++Cl-;NH4NO3==NH4++NO3-;
╢■бв╚▄╥║╡─╦сЙA╨╘╡─ПК╚є
1.╦сЙA╢╚г║╙├Бэ▒э╩╛╚▄╥║╡─╦с╨╘╗ҐЙA╨╘╡─ПК╚є│╠╢╚����бг
2.pH╘З╝И╙├Бэ╢и┴┐╡─Ьy╢и╚▄╥║╡─╦сЙA╢╚бг
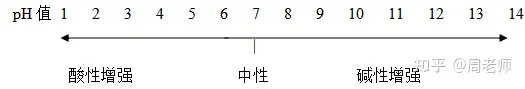
╚▄╥║╡─pH╓╡┼c╦сЙA╨╘ъP(guибn)╧╡:
pH=7����гм╚▄╥║│╩╓╨╨╘;pH<7гм╚▄╥║│╩╦с╨╘����гм╟╥pH╘╜╨б����гм╦с╨╘╘╜ПК;pH>7����гм╚▄╥║│╩ЙA╨╘гм╟╥
pH╘╜┤ґ����гмЙA╨╘╘╜ПКбг
3.pH╘З╝И╡─╩╣╙├╖╜╖и:
╙├─zю^╡╬╣▄(╗Ґ▓г┴з░Є)░╤┤¤Ьy╘З╥║╡╬(╗Ґ═┐)╘┌pH╘З╝И╔╧����гм╚╗║ґ░╤╘З╝Ия@╩╛╡─юБ╔л(░ы╖╓чКГ╚(nииi))┼cШ╦Ь╩▒╚╔л┐иМж╒╒гмШ╦Ь╩▒╚╔л┐и╔╧╧р═мюБ╔л╡─pH╝┤Ющ╘У╚▄╥║╡─pH����бг
╫в╥тг║
(1)▓╗─▄╓▒╜╙░╤pH╘З╝И╜■╚ы┤¤Ьy╚▄╥║╓╨гм╥╘├тОз╚ыыs┘|(zhим)����гм═мХr▀@╖N▓┘╫і┐╔─▄┼▌╡ЄpH╘З╝И╔╧
╥╗▓┐╖╓╓╕╩╛Дйгм╥╘╓┬▒╚╔л░l(fиб)╔·▌^┤ґ╡─╒`▓ю;
(2)▓╗─▄╧╚╙├╦оМвpH╘З╝ИЭЩЭё����гм╘┘▀M╨╨Ьy╘Згм╥ҐЮщ╦оЭЩЭё║ґ╡─pH╘З╝ИМвЬy╢и╡─╩╟╧бсМ║ґ╚▄
╥║╡─pH����бг
(3)╬╥ВГМНҐЮ╩╥╥╗Ш╙╩╣╙├╡─pH╘З╝И╩╟ПV╖║pH╘З╝ИгмЬy│І╡─pH╓╡╩╟1~14╡─╒√Ф╡(shи┤)����бг
(4)Ющ┴╦▒╚▌^╛л┤_╡─Ьy╢и╚▄╥║╡─pHгм╬╥ВГ┐╔╥╘╙├╛л├▄pH╘З╝И║═╦с╢╚╙Л(╙╓╖QpH╙Л)БэЬy┴┐����бг
╚¤бв╚▄╥║╦сЙA╨╘┼c╔·├№╗юД╙╡─ъP(guибn)╧╡
1.╚╦╡─ґw╥║╙╨╥╗╢и╡─╦сЙA╢╚����бг╤к╥║бв╜M┐Чщg╥║║═╝Ъ░√Г╚(nииi)╥║╡─╦сЙA╢╚╢╝╜╙╜№╙┌╓╨╨╘����гм╢Ї╟╥╫Г╗пШO╨б;
2.╬╕╥║╡─pH╘┌0.9~1.5╓ощgгм╘┌▀@Ш╙╡─нh(huивn)╛│╓╨шF╨╝╢╝┐╔▒╗╚▄╜т����гм╡л╬╕▒╛╔эЕs─▄░▓╚╗Яoэж����бг╥ҐЮщ╬╕└я╙╨╥╗М╙“╒│╥║╞┴╒╧”����гм╦№╩╟╙╔╒│╥║╝Ъ░√║═╔╧╞д╝Ъ░√╖╓├┌│І╡─╥╗╖N─zГІаю╒│╥║гм╘┌╬╕╒│─д▒э├цШЛ(gи░u)│╔╥╗ВА▒г╫o─д����гм╙├Бэ▒г╫o╬╕гм╖└╓╣╬╕╦сМж╞ф▒╛╔э╡─╕п╬g╝░╬╕╡░░╫├╕Мж╬╕▒╛╔э╡─╧√╗п����гм▀А─▄╖└╓╣┤╓▓┌╡─╩│╬яМж╬╕╡─ЩC╨╡╨╘УpВ√бг
3.┤ґ╢рФ╡(shи┤)╡─▐r(nиоng)╫і╬я▀m╥╦╘┌╜╙╜№╓╨╨╘(pH╘┌6.5~7.5╓ощg)╡─═┴╚└╓╨╔·щL����гм╘┌╕─┴╝╦с╨╘═┴╚└Хrгм╬╥ВГ╥╗░у╩╟╩╣╙├╩ь╩п╗╥Бэ╒{(diидo)╣Э(jiиж)╞ф╦сЙA╢╚����бг
4.╙ъ╦о╥╗░у│╩┬╘╦с╨╘(╙╔╙┌┐╒Ът╓╨╡─╢■╤є╗п╠╝╚▄╜т╘┌╙ъ╦о╓╨)гм╚╦ВГ╥╗░у░╤pH╨б╙┌5.6 ╡─╙ъ╦о╖QЮщ╦с╙ъ����бг
§7.2 │г╥К╡─╦с║═ЙA
╥╗����бв│г╥К╡─╦с
1.╔·╗ю╓╨│г╙├╡─╦сг║╬╕╥║╓╨║м╙╨╡─√}╦с(HCl)����гм╨юыК│╪╓╨║м╙╨┴Ґ╦с(H2SO4)����гм╦с╙ъ╓╨║м╙╨╡─┴Ґ╦с╝░╧є╦с(HNO3)гм╩│┤╫╓╨║м╙╨╡─┤╫╦с(CH3COOH╗ҐHAc);яЛ┴╧╓╨┐╔─▄║м╙╨╡─╠╝╦с����бвЩО├╩╦с╡╚бг
2.╦с╡─╖╓юРг║Яo╤є╦с(╚чHCl)����бв║м╤є╦с(HNO3бвH2SO4)╡╚����бг
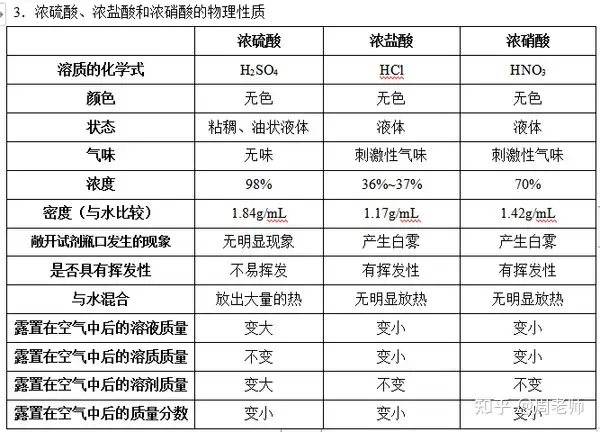
╫в╥тг║Эт┴Ґ╦с╛▀╙╨╥╗╢и╡─╠╪╨╘г║
(1)╬№╦о╨╘(╬я└э╨╘┘|(zhим))╙├╙┌Ътґw╕╔╘ягм╡л│¤NH3╡╚ЙA╨╘Ътґw│¤═т[2NH3+ H2SO4== (NH4)2SO4]
(2)├У╦о╨╘(╗пМW╨╘┘|(zhим))——║┌├ц░№МНҐЮ(Эт┴Ґ╦с┼c╒с╠╟╖┤Ск(yийng)����гм╩╣╓о╠┐╗п����бг)
(3)ПК╤є╗п╨╘����гм╕п╬g╨╘——┼c╜ЁМ┘░l(fиб)╔·╖┤Ск(yийng)гм╔·│╔╡─Ътґw▓╗╔·│╔ЪфЪт╢Ї╩╟╢■╤є╗п┴Ґ����бг
╘┌╝╙Яс╡─Чl╝■╧┬гм─▄┼c┼┼╘┌Ъф║ґ├ц╡─╜ЁМ┘(╚чCu)╖┤Ск(yийng)����гм╚чг║
Cu+2H2SO4(Эт)бі==CuSO4+SO2↑+H2O
╙╓╚чгм└ф╡─Эт┴Ґ╦с┼cшF╗ҐфX╖┤Ск(yийng)║ґ����гм─▄╔·│╔╥╗М╙╓┬├▄╡─╤є╗п─дгм╫ш╓╣╖┤Ск(yийng)▀M╥╗▓╜▀M╨╨����бг
(4)Эт┴Ґ╦с╡─╧бсМг║╦с╚ы╦огм╤╪╞і▒┌����гм▓╗ФрФЗ░ш����бг
Эт┴Ґ╦с╚▄╙┌╦о╖┼│І┤ґ┴┐╡─╦о����гм╫у╥╘╩╣╦о╖╓╖╨Ґvгм▓в╟╥╦о╡─├▄╢╚╨б╙┌Эт┴Ґ╦с╡─├▄╢╚����бг╚ч╣√░╤╦о╡╣╚ыЭт┴Ґ╦с╓╨����гм╦о╛═Х■╕б╘┌Эт┴Ґ╦с╔╧├цгм╚▄╜тХr╖┼│І┤ґ┴┐╡─Яс����гм╓┬╩╣╦о╖╨Ґv╢Ї╩╣┴Ґ╦с╥║╡╬╧Ґ╦─╓▄яwЮR╢Ї╘ь│╔╩┬╣╩бг
(5)░▓╚л╩┬╣╩╡─╠О└эг║Эт┴Ґ╦сЮR╡╜╞д─w╔╧║ґ����гм╩╫╧╚╤╕╦┘╙├─и▓╝Мв╞ф▓┴╩├гм╚╗║ґ╙├┤ґ┴┐╦оЫ_╧┤����гм╫ю║ґ╙├3%~5%╡─NaHCO3═┐╖ґ����бг
╧б┴Ґ╦сЮR╡╜╞д─w╔╧║ґ����гмСк(yийng)╘УёR╔╧Ы_╧┤гм╥ҐЮщыS╓Ї╧б┴Ґ╦с╓╨╚▄Дй╡─╒Є░l(fиб)����гм╥▓Х■╫Г│╔Эт┴Ґ╦сбг
4.╦с╡─╗пМW╨╘┘|(zhим)
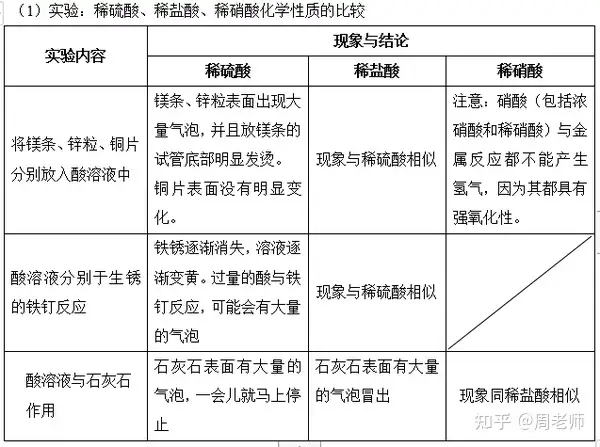
┐В╜Y(jiиж)г║╦с╦ї╛▀╙╨╡─╣▓═м╠╪№cг║
╦с╘┌╦о╚▄╥║╓╨╢╝─▄ыКыx│ІЪфыx╫╙����гм╥Ґ┤╦╦с╚▄╥║Х■╛▀╙╨╘S╢р╣▓═м╡─╨╘┘|(zhим)(╦с╡─╬х┤ґ═и╨╘)г║
(1)╦с╚▄╥║┼c╦сЙA╓╕╩╛Дй╡─╖┤Ск(yийng)
A.╫╧╔л╩п╚я╘З╥║╗Ґ╦{╔л╩п╚я╘З╝И╙І╡╜╦с╚▄╥║╫Г╝t╔л;
B.Яo╔л╖╙╠к╘ЗДй╙І╡╜╦с╚▄╥║▓╗╫Г╔лбг
╠с╨╤г║╫╧╔л╩п╚я╘ЗДй╫Г╔л╟щЫrЮщг║“╦с╝tЙA╦{”;╩╟╓╕╩╛Дй╫Г╔л����гм╢Ї╖╟┤¤Ьy╚▄╥║▒╛╔э╫Г╔лбг
(2)╦с╚▄╥║┼c─│╨й╜ЁМ┘╖┤Ск(yийng)
╦с╚▄╥║+ (Ъф╟░)╜ЁМ┘→ √}╚▄╥║+ ЪфЪт
╫в╥тг║
A.╘┌╜ЁМ┘╗юД╙╨╘эШ╨Ґ▒э╓╨����гм┼┼╘┌Ъф╟░├ц╡─╜ЁМ┘─▄╓├УQ│І╦с╓╨╡─Ъфгм┼┼╘┌Ъф║ґ├ц╡─╜ЁМ┘Дt▓╗─▄;
B.┼┼╘┌╜ЁМ┘╗юД╙╨╘эШ╨Ґ▒э╘╜╟░├ц╡─╜ЁМ┘����гм╖┤Ск(yийng)мF(xiидn)╧ґ╘╜Дб┴╥����гм╦┘╢╚╘╜┐ь����гм╚чMg╖┤Ск(yийng)╙╨├ія@╖┼
ЯсмF(xiидn)╧ґ;
C.ПК╤є╗п╨╘╦с┼c╜ЁМ┘╖┤Ск(yийng)║ґгм▓╗─▄╔·│╔ЪфЪт����гм╢Ї╩╟╔·│╔╦обг╚чЭт┴Ґ╦с����бв╧є╦с╡╚ПК╤є╗п╨╘╦с;
D.╘УюР╖┤Ск(yийng)М┘╙┌╓├УQ╖┤Ск(yийng)
╚чг║Zn + 2HCl == ZnCl2+ H2↑;Fe + H2SO4== FeSO4 + H2↑
(3)╦с╚▄╥║┼c─│╨й╜ЁМ┘╤є╗п╬я╖┤Ск(yийng)(╜ЁМ┘╤є╗п╬я╙╓╖QЙA╨╘╤є╗п╬я)
╦с╚▄╥║+ ╜ЁМ┘╤є╗п╬я→ √}╚▄╥║+ ╦о
╫в╥тг║╘У╖┤Ск(yийng)▀^│╠╓╨����гм╜ЁМ┘╘к╦╪╡─╗п║╧Гr▓╗╫Ггм╦с╓╨╡─╘н╫╙ИF▓╗╫Г
╚чг║CuO + 2HCl == CuCl2+ H2O;Fe2O3+ 3H2SO4== Fe2(SO4)3+ 3H2O
ZnO + 2HNO3== Zn(NO3)2+H2O
(4)╦с╚▄╥║┼cЙA╡─╖┤Ск(yийng)(╙╓╖QЮщ╓╨║═╖┤Ск(yийng))
╦с+ЙA→√}+╦о
(5)╦с╚▄╥║┼c─│╨й√}╖┤Ск(yийng)
╦с╚▄╥║+ √}→ ╨┬╦с+ ╨┬√}
╫в╥тг║A.╬╥ВГ═и│г╙І╡╜╡─√}╩╟╠╝╦с√}����гм╥Ґ┤╦╜^┤ґ▓┐╖╓╖┤Ск(yийng)╩╟г║
╦с+ ╠╝╦с√}→ ╨┬√}+ ╦о+ ╢■╤є╗п╠╝
╚чг║CaCO3+ 2HCl == CaCl2+ H2O + CO2↑;Na2CO3+ H2SO4== Na2SO4+ H2O + CO2↑;
K2CO3+ 2HNO3== 2KNO3+ H2O + CO2↑;
MgCO3+ CH3COOH == (CH3COO)2Mg + H2O + CO2↑;
B.─│╨й╠╪╩т╡─√}─▄┼c╦с╖┤Ск(yийng)гм╔·│╔╠╪╩т╡─│┴╡э
╚чг║HCl + AgNO3== AgCl↓+ HNO3;BaCl2+ H2SO4== BaSO4↓+ 2HCl
╤a│фг║Cl-╝░SO42-╡─ЩzҐЮ
A.╧Ґ┤¤Ьy╚▄╥║╓╨╝╙╚ыAgNO3╚▄╥║║ґ╙╨░╫╔л│┴╡э╔·│╔����гм╡╬╚ы╧б╧є╦с╚▄╥║║ґ����гм│┴╡э▓╗╧√╩з����гмДt╚▄╥║╓╨║м╙╨Cl-гм╚ч╣√Ы]╙╨│┴╡э╗Ґ╒▀│┴╡э╧√╩з����гмДt▓╗║м╙╨Cl-бг
B.╧Ґ┤¤Ьy╚▄╥║╓╨╝╙╚ыBa(NO3)2╚▄╥║║ґ╙╨░╫╔л│┴╡э╔·│╔����гм╡╬╚ы╧б╧є╦с╚▄╥║║ґгм│┴╡э▓╗╧√╩з����гмДt╚▄╥║╓╨║м╙╨SO42-гм╚ч╣√Ы]╙╨│┴╡э╗Ґ╒▀│┴╡э╧√╩з����гмДt▓╗║м╙╨SO42-бг
╢■.│г╥К╡─ЙA
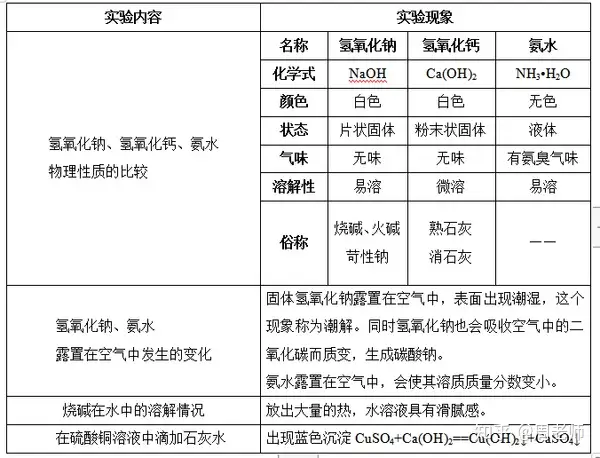
1.╙╨ъP(guибn)ЙA╡─╥╗╨й╨╘┘|(zhим)▒╚▌^
Я¤ЙA╛▀╙╨ПК╕п╬g╨╘����гмЪф╤є╗пт}║═░▒╦о╥▓╛▀╙╨╥╗╢и╡─╕п╬g╨╘����бг
Ъф╤є╗птc╚▄╥║─▄ЙҐ┼cю^░l(fиб)����бвыu╡░╟хбв╓▓╬я╙═╡╚░l(fиб)╔·╗пМW╖┤Ск(yийng)����гм╚▄╜т╞ф╓╨╡─╡░░╫┘|(zhим)бг
2.ЙA╡─╣▓═м╨╘┘|(zhим)
╙╔╙┌ЙAыКыx║ґ╢╝─▄╔·│╔OH-����гм╥Ґ┤╦╥▓╛▀╙╨╧р═м╡─╨╘┘|(zhим)(ЙA╡─╦─┤ґ═и╨╘)г║
╚чг║NaOH == Na++ OH-;NH3•H2O == NH4++OH-;
(1)┼c╦сЙA╓╕╩╛Дй╫і╙├
A.╫╧╔л╩п╚я╘ЗДй╗Ґ╝t╔л╩п╚я╘З╝И╙І╡╜ЙA╚▄╥║╫Г╦{;
B.Яo╔л╖╙╠к╙І╡╜ЙA╚▄╥║╫Г╝tбг
(2)┼c─│╨й╖╟╜ЁМ┘╤є╗п╬я╖┤Ск(yийng)(╖╟╜ЁМ┘╤є╗п╬я╙╓╖Q╦с╨╘╤є╗п╬я)
ЙA╚▄╥║+ ╖╟╜ЁМ┘╤є╗п╬я→ √}+ ╦о
╚чг║2NaOH + CO2== Na2CO3+ H2O;Ca(OH)2+ SO2== CaSO3↓+ H2O;
(3)┼c╦с╚▄╥║╡─╖┤Ск(yийng)
ЙA+╦с→√}+╦о
(4)─▄┼c─│╨й√}╖┤Ск(yийng)
ЙA╚▄╥║+ √}╚▄╥║→ ╨┬√}+ ╨┬ЙA
╚чг║CuSO4+ 2NaOH == Na2SO4+ Cu(OH)2↓Ca(OH)2+Na2CO3==2NaOH+CaCO3↓
3.П═╖╓╜т╖┤Ск(yийng)г║╙╨Г╔╖N╗п║╧╬я╧р╗е╜╗УQ│╔╖╓����гм╔·│╔┴э═тГ╔╖N╗п║╧╬я╡─╖┤Ск(yийng)����бг
┐╔╥╘╙├г║AB + CD == AD + CB ▒э╩╛бг
╠╪№cг║(1)╖┤Ск(yийng)╬я����бв╔·│╔╬я╛ї╓╗╙╨Г╔╖N╗п║╧╬я;
(2)░l(fиб)╔·╖┤Ск(yийng)╡─Г╔╖N╗п║╧╬я╧р╗е╜╗УQ│╔╖╓;
(3)╕і╘к╦╪╡─╗п║╧Гr╘┌╖┤Ск(yийng)╟░║ґ╛ї▓╗╕─╫Г����бг
╫вг║ыy╚▄╨╘ЙA╩▄Яс╥╫╖╓╜т(▓╗М┘╙┌ЙA╡─═и╨╘)
§7.3 О╫╖N╓╪╥к╡─√}
╥╗����бв√}
1.√}╡─╖╓юРг║╥└У■(jи┤)╜M│╔√}╡─ъЦыx╫╙║═╦с╕ї╡─╖NюР▀M╨╨╖╓юР
╕їУ■(jи┤)ъЦыx╫╙╡─▓╗═мгм√}┐╔╥╘╖╓Ющтc√}����бвтЫ√}бвцV√}����бвшF√}бвф@√}╡╚����бг(┬╚╗птcЮщтc√})
╕їУ■(jи┤)╦с╕ї╡─▓╗═мгм√}┐╔╥╘╖╓Ющ┴Ґ╦с√}����бв╠╝╦с√}бв╧є╦с√}����бв√}╦с√}╡╚����бг(┬╚╗птcЮщ√}╦с√})
2.╦с����бвЙAбв√}╡─╚▄╜т╨╘╥О(guий)┬╔г║
в┘╦с╢╝╚▄;в┌╚▄ЙA╙╨╬х╬╗г║тЫ����бвтcбвф@����бвт}бвф^;в█тЫ√}����бвтc√}бвф@√}����бв╧є╦с√}╢╝┐╔╚▄;в▄√}╦с√}╓╗╙╨┬╚╗пуy▓╗┐╔╚▄;в▌┴Ґ╦с√}╓╗╙╨┴Ґ╦сф^▓╗┐╔╚▄;в▐╠╝╦с√}╓╗╚▄тЫ����бвтc����бвф@����гм╩г╧┬╢╝▓╗╚▄бг
╫в╥тг║AgCl����бвBaSO4▓╗ГH▓╗╚▄╙┌╦огм╢Ї╟╥▓╗╚▄╙┌╧б╧є╦с����бг
╞▀╖N│г╥К│┴╡эг║AgCl↓BaSO4↓Cu(OH)2↓F e(OH)3↓Mg(OH)2↓BaCO3↓CaCO3↓
3.√}╡─╗пМW╨╘┘|(zhим)г║
(1)√} + ╜ЁМ┘ → ╨┬√} + ╨┬╜ЁМ┘
╘┌╜ЁМ┘╗юД╙╨╘эШ╨Ґ▒э╓╨гм│¤╖╟│����г╗юЭК╡─╜ЁМ┘═тгм┼┼╘┌╟░├ц╡─╜ЁМ┘╥╗░у┐╔╥╘Мв╬╗╙┌╞ф║ґ├ц╡─����бв▒╚╦№▓╗╗юЭК╡─╜ЁМ┘П─╦№ВГ╡─√}╚▄╥║╓╨╓├УQ│ІБэгм╚чг║
Zn + CuSO4== ZnSO4 + Cu Cu + 2AgNO3== 2Ag + Cu(NO3)2
(2)─│╨й√}╚▄╥║╘┌╥╗╢иЧl╝■╧┬─▄┼c╦с╗ҐЙA░l(fиб)╔·П═╖╓╜т╖┤Ск(yийng)
П═╖╓╜т╖┤Ск(yийng)г║╙╔Г╔╖N╗п║╧╬я╗е╧р╜╗УQ│╔╖╓����гм╔·│╔┴э═тГ╔╖N╗п║╧╬я╡─╖┤Ск(yийng)����бг
╚чг║CuSO4+ Ca(OH)2 === Cu(OH)2↓ + CaSO4
Na2CO3+2HCl == 2NaCl+H2O+CO2↑
П═╖╓╜т╖┤Ск(yийng)░l(fиб)╔·╡─Чl╝■г║
a.╙╨│┴╡э╔·│╔;b.╙╨Ътґw╖┼│І;c.╙╨╦о╔·│╔;
d.╚ч╣√╩╟Ы]╙╨╦сЕв╝╙╡─╖┤Ск(yийng)����гмДtГ╔╖N╖┤Ск(yийng)╬я▒╪эЪ╢╝╚▄╙┌╦обг
╢■����бвО╫╖N│г╥К╡─√}
1.┬╚╗птc(NaCl)
╘┌╫╘╚╗╜ч╓╨╖╓▓╝║▄ПV╖║гм║г╦о╓╨║м╙╨┤ґ┴┐┬╚╗птc����бг
2.╠╝╦стc(Na2CO3)
(1)╦╫├√г║╝ГЙAбв╠K┤Ґ(2)╝ГЙA▓╗╩╟ЙA����гм╩╟√}(╦о╚▄╥║я@ЙA╨╘)
(3)╙├═╛г║▓г┴збв╘ь╝И����бв╝П┐Ч║═╧┤ЬьДй╡─╔·оa(chигn)╡╚
(4)Na2CO3+ 2HCl === 2NaCl + CO2↑+ H2O
3.╠╝╦сЪфтc(NaHCO3)
(1)╦╫├√г║╨б╠K┤Ґ(2)╙├═╛г║▒║╓╞╕т№cбв╓╬пЯ╬╕╦с▀^╢р
(3)NaHCO3+ HCl === NaCl + CO2↑+ H2O
4.╠╝╦ст}(CaCO3)
(1)┤ґ└э╩пбв╩п╗╥╩п����бвчК╚щ╩п����бв╪РЪдбв╒ф╓щ����бв╡░ЪдбвхБаt║═╦оЙ╪╡─╦о╣╕╡─╓і╥к│╔╖╓
(2)╙├═╛г║╜и╓■▓─┴╧����бв╤aт}Дй(3)CaCO3+2HCl===CaCl2+ CO2↑+H2O
╤a│фг║╠╝╦с√}(CO32-бвHCO3-)╡─ЩzҐЮг║
A.╧Ґ┤¤Ьy╚▄╥║╓╨╝╙╚ы╧бHCl║ґ╙╨Ът┼▌╔·│╔����гмМвоa(chигn)╔·╡─Ътґw═и╚ы│╬╟х╩п╗╥╦огм╚Є│╬╟х╩п╗╥
╦о╫ГЬЖЭс����гмДt╚▄╥║╓╨║м╙╨CO32-;╚Є│╬╟х╩п╗╥╦оЯo╫Г╗пгмДt╚▄╥║╓╨▓╗║м╙╨CO32-����бг
B.╧Ґ┤¤Ьy╚▄╥║╓╨╝╙╚ыBaCl2╚▄╥║║ґ╙╨░╫╔л│┴╡э╔·│╔����гм╡╬╚ы╧бHCl║ґ����гм│┴╡э╧√╩з╟╥╙╨Ът┼▌╔·
│╔гмДt╚▄╥║╓╨║м╙╨CO32-����бг
CaCO3+ 2HCl == CaCl2+ H2O + CO2↑
Na2CO3+ 2HCl == 2NaCl + H2O + CO2↑
NaHCO3+ HCl == NaCl + H2O + CO2↑
╚¤бв╗пМW╖╩┴╧
▐r(nиоng)╫і╬я╡─╔·щL╨ш╥кN����бвPбвK╡╚аIЁB(yигng)╘к╦╪����бг║м╙╨▀@╨й╘к╦╪╡──│╨й╬я┘|(zhим)┐╔╥╘╫іЮщ╖╩┴╧бг═и▀^╗пМW╝╙╣д╔·оa(chигn)╡─╖╩┴╧����гм╖Q╫і╗пМW╖╩┴╧бг
1����бв│г╙├╡─╖╩┴╧г║
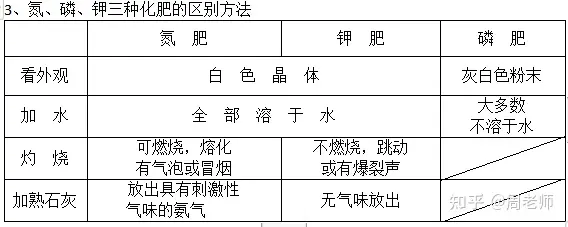
╗пМW╖╩┴╧г║░▒Ът(NH3·H2O)����бв╠╝╦сЪфф@(NH4HCO3)����бв┴Ґ╦стЫ(K2SO4)����бв┴╫╡V╖█[╓і╥к│╔╖╓┴╫╦ст}Ca3(PO4)2]бв┴Ґ╦сф@[(NH4)2SO4]����бв─Ґ╦╪[CO(NH2)2]бв╧є╦стЫ(KNO3)����бв┴╫╦с╢■Ъфф@(NH4H2PO4)бг
▐r(nиоng)╝╥╖╩┴╧г║╚чО¤╖╩����бв╚╦╝S─Ґбв╛G╖╩╡╚����бг
2����бв╡к╖╩╫і╙├г║┤┘▀M╓▓╬я╟o����бв╚~╔·щL├п╩вбв╚~╔лЭт╛G(┤┘├ч)╚▒╡кг║╚~№S
тЫ╖╩╫і╙├г║┤┘╩╣╫і╬я╔·щL╜бЙ╤����бв╟oЧU┤╓╙▓гм┐╣╡╣╖№(Й╤╢Т)╚▒тЫг║╚~╝т░l(fиб)№S����гм╥╫╡╣╖№
┴╫╖╩╫і╙├г║┤┘▀M╓▓╬я╕ї╧╡░l(fиб)▀_гм╦ы┴г╘І╢р����гмяЦЭM(┤▀╣√)╚▒┴╫г║╔·щL▀t╛Пгмоa(chигn)┴┐╜╡
╡═����гм╕ї╧╡▓╗░l(fиб)▀_
4бвф@СB(tидi)╡к╖╩┼cЙA╗ь║╧╝╙Яс����гм╢╝╙╨░▒Ът╖┼│І:
(NH4)2SO4+ 2NaOH бі==Na2SO4 + 2NH3↑+ 2H2O
NH4NO3+NaOH бі==NaNO3+NH3↑+H2O
░▒Ът╙╨┤╠╝д╨╘Ът╬╢����гм─▄╩╣?jiиж)ёЭЩ╡─╝t╔л╩п╚я╘З╝И╫Г╦{����гм▀@╨й┐╔╙├╙┌ф@СB(tидi)╡к╖╩╡─ЩzҐЮбг
NH4+╡─ЩzҐЮ:
╘ЗДйг║ЙA(NaOH����бвCa(OH)2╡╚)����бвЭёЭЩ╡─╝t╔л╩п╚я╘З╝И
╕╜г║Ж╬┘|(zhим)бв╤є╗п╬я����бв╦сбвЙA����бв√}╡─╧р╗еъP(guибn)╧╡
(1)╜ЁМ┘Ж╬┘|(zhим)+╦с---√}+ЪфЪт(╓├УQ╖┤Ск(yийng))
1.ф\║═╧б┴Ґ╦сZn+H2SO4=ZnSO4+H2↑(╫ю│г╙├)
(МНҐЮ╩╥╓╞H2╙├╡─╜ЁМ┘╙╨Zn,Fe,Mg,Alгм╦с╙╨╧бH2SO4║═╧бHCl)
(2)╜ЁМ┘Ж╬┘|(zhим)+√}(╚▄╥║)---┴э╥╗╖N╜ЁМ┘+┴э╥╗╖N√}
2.шF║═┴Ґ╦су~╚▄╥║╖┤Ск(yийng)г║Fe+CuSO4=FeSO4+Cu
3.фX║═╧є╦суy╚▄╥║╖┤Ск(yийng)г║Al+3AgNO3=Al(NO3)3+3Ag
(3)ЙA╨╘╤є╗п╬я(╜ЁМ┘╤є╗п╬я)+╦с---√}+╦о
4.╤є╗пшF║═╧б┴Ґ╦с╖┤Ск(yийng)г║Fe2O3+3H2SO4=Fe2(SO4)3+3H2 O
5.╤є╗пт}║═╧б√}╦с╖┤Ск(yийng)г║CaO+2HCl=CaCl2+H2 O
(4)╦с╨╘╤є╗п╬я(╖╟╜ЁМ┘╤є╗п╬я)+ЙA--------√}+╦о
6.┐┴╨╘тc▒й┬╢╘┌┐╒Ът╓╨╫Г┘|(zhим)г║2NaOH+CO2=Na2CO3+H2 O
7.╧√╩п╗╥╖┼╘┌┐╒Ът╓╨╫Г┘|(zhим)г║Ca(OH)2+CO2=CaCO3↓+H2 O
(5)╦с+ЙA--------√}+╦о(╓╨║═╖┤Ск(yийng))
8.√}╦с║═Я¤ЙA╖┤Ск(yийng)г║HCl+NaOH=NaCl+H2O
9.√}╦с║═Ъф╤є╗пт}╖┤Ск(yийng)г║2HCl+Ca(OH)2=CaCl2+2H2 O
10.Ъф╤єтc║═┴Ґ╦с╖┤Ск(yийng)г║2NaOH + H2SO4==Na2SO4+2H2O
(6)╦с+√}--------┴э╥╗╖N╦с+┴э╥╗╖N√}
11.┤ґ└э╩п┼c╧б√}╦с╖┤Ск(yийng)г║CaCO3+2HCl=CaCl2+H2 O+CO2↑(МНҐЮ╩╥╓╞CO2)
12.╠╝╦стc┼c╧б√}╦с╖┤Ск(yийng):Na2CO3 +2HCl=2NaCl+H2 O+CO2↑
13.┴Ґ╦с║═┬╚╗пф^╚▄╥║╖┤Ск(yийng)г║H2SO4+BaCl2=BaSO4↓+2HCl
(7)ЙA+√}---┴э╥╗╖NЙA+┴э╥╗╖N√}
14.Ъф╤є╗пт}┼c╠╝╦стcг║Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
15.┴Ґ╦су~╚▄╥║┼cЪф╤є╗пф^г║CuSO4+Ba(OH)2=BaSO4↓+Cu(OH)2↓
(8)√}+√}---Г╔╖N╨┬√}
16.┬╚╗птc╚▄╥║║═╧є╦суy╚▄╥║г║NaCl+AgNO3=AgCl↓+NaNO3
17.┴Ґ╦стc║═┬╚╗пф^г║Na2SO4+BaCl2=BaSO4↓+2NaCl
П═╖╓╜т╖┤Ск(yийng)▒╪эЪ╔·│╔│┴╡э����гмЪтґw╗Ґ╦о╔·│╔▓┼─▄░l(fиб)╔·����гм╟╥╔·│╔╬я╡─╘к╦╪╗п║╧Гr▓╗╫Г����бг
+1Гr:HClO;NaClO;Ca(ClO)2.
+5Гr:HClO3;KClO3.
+7Гr:HClO4;KClO4.
бббб Ъg╙н╩╣╙├╩╓ЩCбв╞╜░х╡╚╥╞Д╙╘O(shии)Вф╘LЖЦ╓╨┐╝╛W(wигng)����гм2023╓╨┐╝╥╗┬╖┼у░щ═м╨╨гб>>№cУЄ▓щ┐┤
















